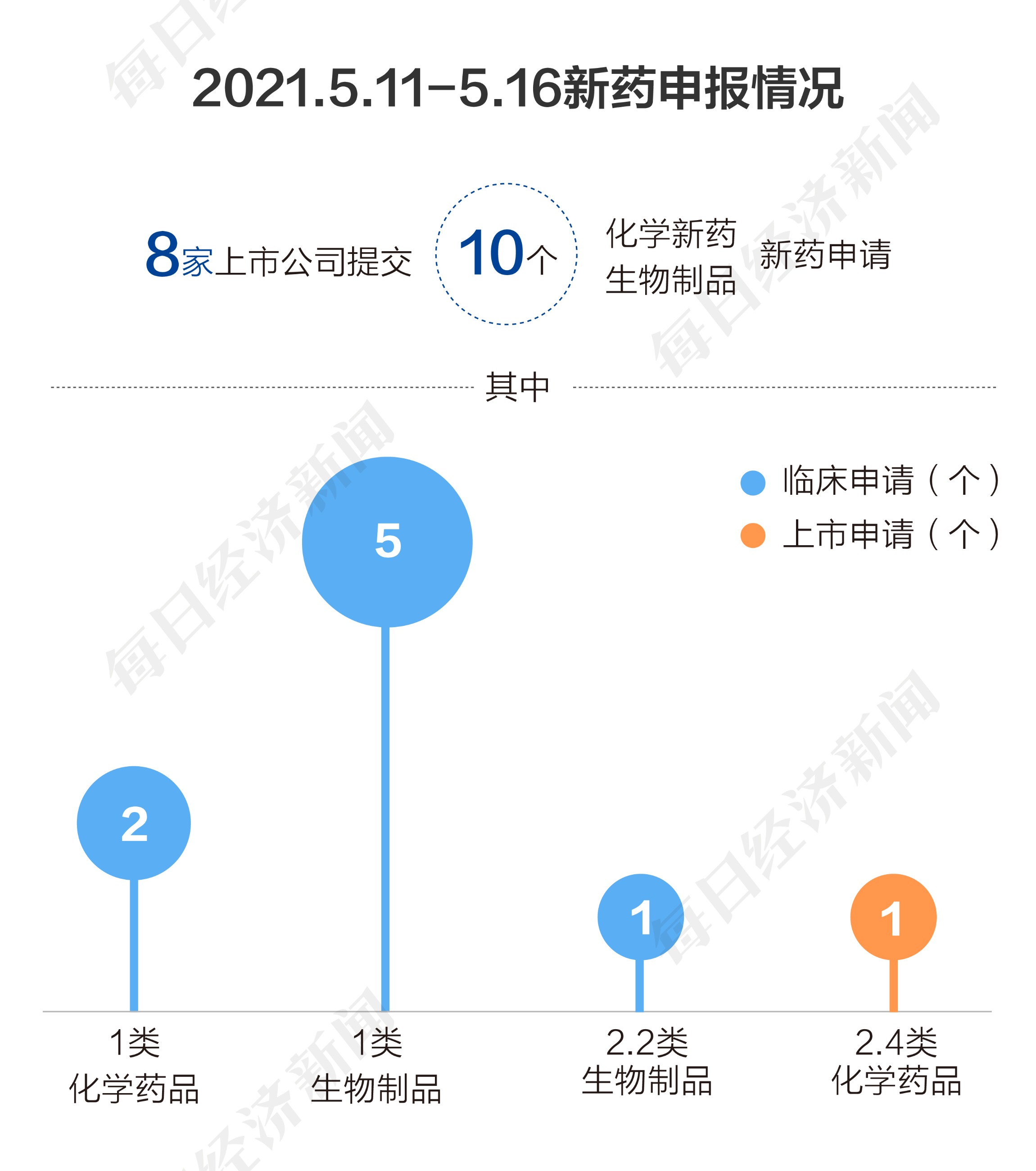
根据丁香园Insight数据库统计,5月11日至16日,国家药品监督管理局药品审评中心共收到8家上市公司提交的10个化学新药、生物制品新药申请。
一周新药申请
本阶段,百济神州(06160,HK)申报2个临床申请,信达生物(01801,HK)、微芯生物(688321,SH)、东曜药业-B(01875.HK)、恒瑞医药(600276,SH)、海正药业(600267,SH)、上海医药(601607,SH)、海思科(002653,SZ)、赛升药业(300485,SZ)申报1个临床申请。
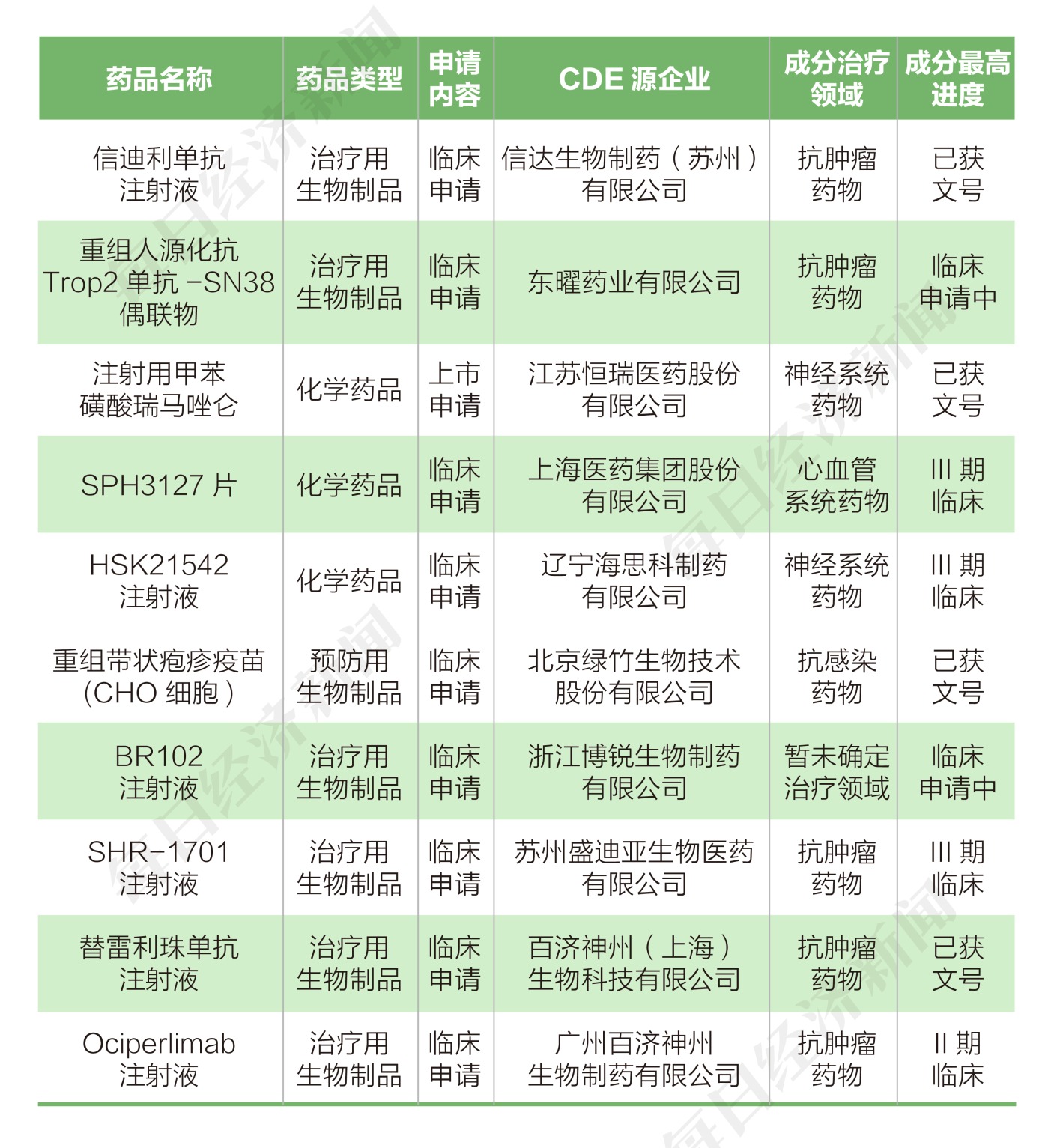
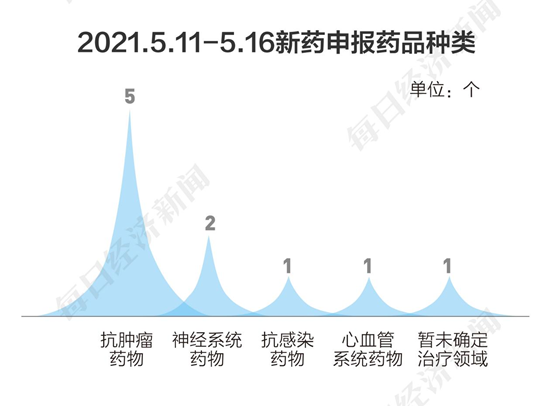
按申请类别划分,本阶段申报类别情况如下:
一周热点评论
1、公告PD-1上市进展,信达生物为何突然拉升8%?
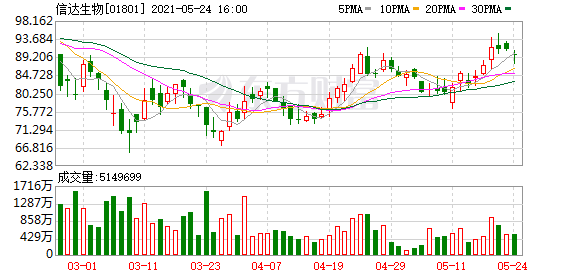
5月14日,信达生物递交PD-1信迪利单抗注射液达伯舒临床申请,达伯舒是国内第一个进入医保目录的PD-1,2020年销售额超过22亿元,目前已有2项适应症在中国获批、3项适应症递交中国上市申请,超过20个临床研究正在进行。
而在5月18日,信达生物一则午间公告引爆资本市场——FDA(美国食品药品监督管理局)已正式受理双方合作开发的PD-1抑制剂药物信迪利单抗注射液联合培美曲塞和铂类用于非鳞状非小细胞肺癌(NSCLC)一线治疗的新药上市申请。
当日午间开盘后,信达生物迅速拉升8%,最高盘中触及94港元/股。
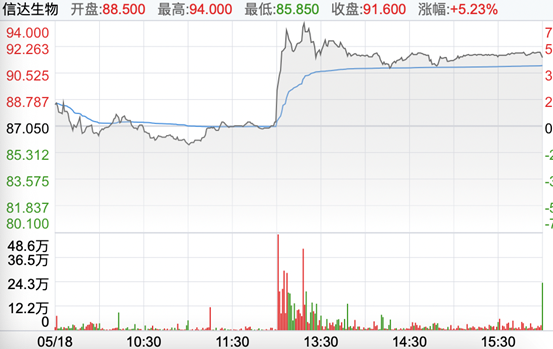
图片来源:东方财富网截图
国内药品要想在美国上市,一般需要在美国当地进行,或者开展全球性的相关临床试验。《掘金创新药》研究员认为,国内白热化竞争下PD-1出海是大势所趋。目前,包括百济神州、恒瑞医药等多个国产PD-1,都在美国开展了一系列临床试验。达伯舒的上市申请基于国内开展的三期临床ORIENT-11的试验结果,而非在美国开展的临床试验。
FDA在受理信中表示,没有发现任何潜在的审查问题,目前,FDA正计划召开一次咨询委员会会议(Advisory Committee)来讨论这次申请。
根据FDA官网介绍,肿瘤委员会由包括主席在内共有13个投票成员。这些成员由普通肿瘤学、儿科肿瘤学、血液肿瘤学、免疫肿瘤学等多个肿瘤领域的顶级专家。Advisory Committee需要审查和评估有关产品的安全性和有效性数据,并进行投票。以投票结果,组委会向FDA提出适当“建议”。
医学史上首款CAR-T,就是组委会投票才通过的,但并不意味着达伯舒的上市申请一定会通过。所以,最终结果如何,还需要等待委员会和FDA的评定。
但是,多家券商已经在为信达生物摇旗呐喊,国金证券和中金分别发布研报,给出好评。
国金证券直接评价其“是中国创新药的里程碑式突破”,是中国创新药企在国际核心重磅创新药领域的牛刀初试。据美国处方药用户付费法案(PDUFA),FDA对信迪利单抗的上市申请做出决议的目标日期是2022年3月。目前FDA计划召开咨询委员会会议以讨论该申请。此进程快于市场预期。
中金的报告更加直白,将信达生物目标价上调13%至110港元,持“跑赢大市”评级。并认为,申报进度超出市场预期,信迪利单抗有望成为首个在美国获批上市的国产PD-1单抗。

2月以来信达生物日K线图片
数据显示,PD-1单抗是近年来全球创新药重要主战场。据Fierce Pharma 5月3日公布,2020年全球销售额前十名的重磅药中,PD-1单抗占据两席,分别是第二与第八位的Keytruda(默克)和Opdivo(BMS),销售额分别为143.8亿美元和79.2亿美元。
中国PD-1能否走上国际舞台接受验证和施展拳脚,我们拭目以待。
2、赛升药业参股公司申报临床申请,国产带状疱疹疫苗何时破冰?
近日,赛升药业参股公司北京绿竹生物技术有限公司向国家药监局药品审批中心申报重组带状疱疹病毒疫苗临床申请。
2020年6月28日,葛兰素史克宣布重组带状疱疹疫苗“欣安立适”在中国上市,打破国内带状疱疹疫苗市场多年空白。在我国,每年有近300万人饱受带状疱疹影响,50岁及以上人群每年新发带状疱疹病例约156万。
目前全球带状疱疹疫苗类型主要有减毒活疫苗、灭活疫苗,代表企业分别默沙东的Zostavax(带状疱疹减毒活疫苗)与葛兰素史克的Shingrix(重组带状疱疹疫苗)。其中从市场份额来看,葛兰素史克的Shingrix占有绝对优势。
除了赛升药业,国内布局研发带状疱疹疫苗的上市公司主要有:长春百克、上海生物制品研究所、沃森生物-艾博生物、智飞生物、康希诺。其中,长春高新旗下疫苗子公司长春百克、中国生物旗下子公司上海生物制品研究所、长春祈健、万泰生物、大连雅立峰采用减毒活疫苗技术,绿竹生物、上海怡道生物和江苏中慧元通正在研发的是重组带状疱疹病毒疫苗。
但是,根据公开资料,复星医药旗下的大连雅立峰、万泰生物均已暂停临床申请,到目前为止都没有披露重启临床试验,带状疱疹疫苗的研发难度可想而知。截至目前,暂无券商就赛升药业参股公司申报带状疱疹病毒疫苗临床申请进行点评。
(文章来源:每日经济新闻)
