继首个国产PD-L1单抗获批不久,第二款国产PD-L1也即将获批。目前国内已有11款PD-1/L1单抗上市,且数量还在持续扩容。面对拥挤的市场,寻找差异化成为PD-L/L1领域“后来者”突围的方向。
在11月19日至11月25日的新发布周期内,基石药业舒格利单抗和再鼎医药的甲苯磺酸奥玛环素的上市申请进入了行政审批阶段,有望于近期正式获批上市;另外,在首款产品奥瑞巴替尼获批上市不久,亚盛医药的另一款重磅品种也步入注册临床阶段。同时,来自维立志博、艾美斐、绿叶制药、天境生物等的10个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。
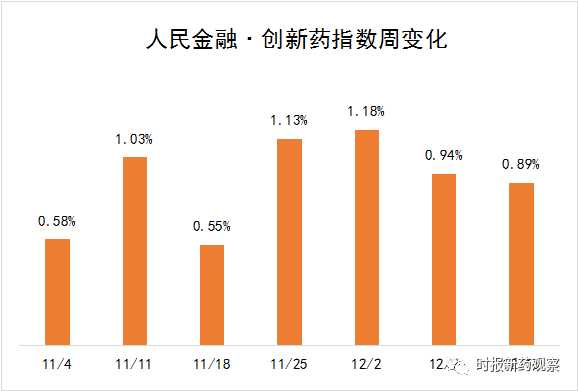
受这些因素推动,新发布周期内,“人民金融·创新药指数”上涨了0.89%,最新报2216.99 点。
PD-1/L1“后来者”如何搅动市场?
继首个国产PD-L1单抗获批不久,近日基石药业舒格利单抗的上市申请(受理号:CXSS2000056)也进入“在审批”阶段,业内预计即将获批上市。如果获批,舒格利单抗将成为国内第三款获批上市的PD-L1单抗,也是国内第12款PD-1/L1单抗。
除此之外,国内还有康方生物、乐普生物、复宏汉霖、嘉和生物、科伦药业、李氏大药厂等的PD-1/L1单抗处于报产阶段,未来两三年PD-1/L1玩家将继续扩容。面对拥挤的市场,“后来者”如何占据一席之地?各药企已经慢慢摸索出了答案。
一个关键因素是,要做差异化竞争。国盛证券研报指出,早期的先行者在该领域市场地位已非常稳固,若想重新定义市场格局,后来者必须要尽快通过独家、创新的组合疗法来颠覆现有的或者开辟新的市场空间。
以舒格利单抗为例,除此次即将获批的适应症,舒格利单抗用于同步或序贯放化疗治疗后未进展的III期非小细胞肺癌(NSCLC)患者的适应症已处于上市申请阶段。目前,还没有PD-1/L1抗体获批用于序贯放化疗后的III期NSCLC患者,这意味着占III期NSCLC患者七成的序贯放化疗患者,尚没有PD-1/L1抗体可用。舒格利单抗瞄准的正是这个巨大的未满足治疗需求。
在两个适应症获批后,舒格利单抗将成为全球首个覆盖晚期NSCLC全人群的PD-1/L1。作为第二梯队的PD-1/L1,凭借差异化的适应症布局,未来舒格利单抗有望在全球肺癌治疗市场占据一席之地。
适应症之外,海外市场正成为国产PD-1/L1的第二战场。
截至目前,君实生物、信达生物、康方生物、百济神州的PD-1的上市申请正在FDA审评之中,恒瑞医药的PD-1正在美国开展III期临床,基石药业预计在2022年向FDA提交舒格利单抗的生物制品上市申请。从时间来看,国产PD-1/L1有望在未来半年内获FDA的首张批文。
PD-1/L1后来者也已经剑指海外市场。上个月,丽珠集团与Bright Peak达成PD-1单抗LZM009的海外授权合作。这是继信达生物、百济神州、君实生物等之后,又一家踏上出海之路的PD-1药企。
12月初,复宏汉霖的PD-1斯鲁利单抗一线治疗小细胞肺癌的国际多中心III期临床研究达到主要研究终点OS。“国际化”是斯鲁利单抗的开发策略之一,目前该药已是国内拥有国际临床数据较多的PD-1产品之一,其在治疗胃癌、鳞状非小细胞肺癌和广泛期小细胞肺癌的研究直接采用国际多中心临床试验。
同时,新的给药途径也正成为PD-1/L1后来者的发力方向。
12月8日,先声药业/思路迪/康宁杰瑞的恩沃利单抗开出首批处方,标志着PD-1/L1产品皮下注射时代的到来。相较于注射剂,皮下注射制剂独具依从性优势,给药快、便捷性高。先声药业表示,恩沃利单抗提供了“30秒给药新选择”。同一天,恒瑞医药皮下注射PD-1单抗SHR-1901也启动临床试验,这是继卡瑞丽珠单抗后,恒瑞医药开发的第二款PD-1单抗。
就便利性而言,PD-L/L1口服小分子更具优势,此类药物也已在路上。目前全球尚无获批上市的PD-L1小分子抑制剂,在国内,红日药业的艾姆地芬片、再极医药的MAX-10181片、阿诺医药的AN4005片、贝达药业的BPI-371153已步入或处于申报临床阶段。
总的来看,对于PD-L/L1开发者来说,希望通过新适应症、新剂型/给药途径、出海寻求市场机会。不过,各路径都有不小难度。开拓新适应症、寻求差异化确实是突围路径,但并不意味着该适应症未来就不会遭遇竞争;而海外市场也已被默沙东等巨头牢牢把持在手中,出海前途未卜。因此,后来者想要居上,还需要拿出一定的硬实力证明自己——更有效、更安全。
再鼎医药将迎来首个抗感染新药
除基石药业舒格利单抗之外,再鼎医药1类新药甲苯磺酸奥玛环素的上市申请也于近日进入了行政审批阶段,预计将在近日正式获批,用于治疗社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤结构感染(ABSSSI)。
据介绍,甲苯磺酸奥玛环素为一种新型四环素,其设计旨在克服四环素耐药性,并具有广谱抗菌活性。该药最初于再鼎医药的合作伙伴Paratek Pharmaceuticals进行开发,并于2018年10月获FDA批准在美国上市。2020年3月,海正医药与再鼎医药达成合作,获得了甲苯磺酸奥玛环素注射剂和口服片剂在中国大陆的独家推广权。
再鼎医药的管线主要围绕肿瘤、抗感染和自身免疫领域进行布局,目前已有3款抗肿瘤药产品在中国上市,甲苯磺酸奥玛环素获批后,将成为其首个上市的抗感染新药。
在自身免疫疾病领域,再鼎医药引进的FcRn拮抗剂efgartigimod有望填补国内重症肌无力(gMG)的临床治疗空白。今年8月,再鼎医药表示将于近期与国家药品监督管理局商讨efgartigimod治疗全身型重症肌无力的潜在加速注册路径。当前,efgartigimod治疗gMG正在接受美国FDA的审查,有望在年底获FDA批准上市。
亚盛医药重磅品种步入注册临床阶段
在首款产品奥瑞巴替尼获批上市不久,亚盛医药细胞凋亡管线又迎来新进展。
12月13日,亚盛医药宣布,其原创1类新药APG-2575治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(R/R CLL/SLL)的关键注册II期临床研究获得国家药监局药审中心批准。
APG-2575是首个在中国进入临床阶段的、本土研发的新型Bcl-2选择性抑制剂。通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而诱导肿瘤细胞凋亡,达到治疗肿瘤的目的。
目前,APG-2575已在美国、中国、澳大利亚、欧洲等全球多地开展包括CLL/SLL在内的多种血液肿瘤和实体瘤的临床研究。最新临床数据显示,APG-2575治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的客观缓解率达80.0%,且安全优势明显,具有“best-in-class”潜力。
西南证券认为,Venetoclax 销售峰值约50亿美元左右,如果APG-2575研发顺利而得以成功上市,凭借其“best-in-class”的潜力,APG-2575有可能与Venetoclax在Bcl-2选择性抑制剂赛道一较高下,迅速在细胞凋亡标靶小分子市场占据份额,成为亚盛医药的重磅产品。
10个创新药项目首次获批临床
在12月10日至12月16日的新发布周期内,来自维立志博、艾美斐、绿叶制药、天境生物等的10个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。
其中,绿叶制药的BA1201和创胜集团的TST005均为靶向PD-L1和TGF-β的双抗,用于肿瘤治疗。理论上,通过阻断PD-1和TGF-β两条信号通路,既解除了体内的免疫抑制,又恢复了机体免疫杀伤能力,因而PD-(L)1/TGF-β双抗有望起到1+1>2的效果。
目前,国内已掀起PD-(L)1/TGF-β双抗的研发热潮,已有恒瑞医药、普密斯、正大天晴、君实生物、友芝友生物、维立志博、齐鲁制药、开拓药业等10余家企业的PD-(L)1/TGF-β双抗步入了临床。这些品种中,恒瑞医药的SHR-1701进展最快,已于11月启动了胃癌和宫颈癌的两项III期临床,SHR-1701项目累计已投入研发费用超2亿元。
天境生物的TJ033721则是国内首个获批临床的靶向肿瘤抗原密蛋白18剪切体2(Claudin 18.2)和T细胞共刺激分子4-1BB的创新双特异性抗体,于12月14日获批临床,拟开展治疗晚期或转移性实体瘤患者的研究。今年7月,TJ033721用于治疗晚期或转移性实体瘤的美国I期临床试验完成首例患者给药。
此外,艾美斐的IPG7236片是国内首款进入临床的CCR8抑制剂,拟用于治疗实体瘤。LBL-019注射液是维立志博自主研发、拥有全球知识产权TNFR2单克隆抗体,用于肿瘤治疗。阿诺生物的AN4005片为其自主开发口服小分子PD-L1抑制剂,即将在美国启动I期临床。这些新成分的纳入,是推动“人民金融·创新药指数”走高的主要原因。

(文章来源:证券时报)
文章来源:证券时报
