2021年以来,MRD渐成风口,国内大小企业争相入局。
作为肿瘤预后管理的刚需产品,市场对MRD检测抱有很高的期待,期待着它能否先早筛一步,成为基因检测玩家的增长引擎。
赛道愈加火热的同时,投资者的辨别难度却越来越大:从技术到出海,MRD大小玩家都在强调自己是赛道领先者。
一个不可忽略的现实是,MRD检测领域火爆归火爆,现在谈“领先”还为时尚早。基于NGS的血液瘤MRD检测产品,才刚刚起步;实体瘤MRD检测产品,更是有待攻克。
不过,一切事物的发展,总是有迹可循。如何才能辨别谁是真正的实力玩家,判断MRD市场的中局乃至终局?基因检测公司的合作伙伴阵容,为我们提供了一个不错的观察窗口。
/ 01 /
评价MRD玩家实力的一个维度:
合作伙伴的数量和质量
当前,虽然各家公司都表示自己技术实力突出,但由于MRD产品还处于研发早期阶段,性能标准并不统一。因此,技术优劣、性能高下,很难简单做出判断。
而基因检测公司MRD产品合作伙伴的阵容,则是衡量MRD玩家实力的一个重要维度。原因在于,随着NGS测序技术带来的改变,血液瘤MRD检测产品在临床试验中的应用已经相当广泛。
当前,药企血液瘤药物的临床试验中,往往会涉及MRD检测。比如,天境生物的核心产品CD47单抗TJ011133,在国内开展的联合阿扎胞苷治疗急性髓系白血病,或骨髓增生异常综合征的I/IIa期临床研究中,便明确表示探索骨髓MRD与预后的相关性。

在药企需求已经爆发的当下,必然已经有基因检测玩家,成为药企的上游供应商。那么,作为MRD检测产品消费者的药企,最核心的需求是什么?
答案是:优异的检测性能、良好的实验室资质。前者直接影响临床试验结果;后者一方面决定了临床试验是否能满足境内、境外合规性要求,另一方面反映了实验室的综合管理能力和质量水平,是检测性能稳定性、检测数据准确性的底层保障。
国际上含金量较高的医学实验室认可体系包括CAP、CLIA、ISO15189认证,目前中国国内已经有一小部分NGS医学检验实验室同时具备了此三项认证。
与此同时,为保障临床试验顺利开展,在合作开展初期药企通常会针对MRD检测合作伙伴的质量管理体系进行严格稽查。由此,通过公司已达成合作的药企数量,我们可以一窥MRD赛道玩家的综合实力。
除了数量,基因检测公司MRD产品合作伙伴的质量也很重要。毕竟,合作伙伴是跨国顶尖药企,还是国内不知名的初创型创新药企,含金量是有差别的。数量与质量并重,无疑是最理想的状态。
/ 02 /
科技部官网告诉你:
谁才是实力玩家
一个现实的问题是,如何找到基因检测玩家MRD产品合作伙伴的情况?答案是,科技部政务服务平台。
中国人类遗传资源具有重要的战略意义,因此涉及到基因检测相关的业务,都需要审批或者备案。只有审批通过或者备案完成,才能进行临床试验。
而无论是审批还是备案,两者都有公示环节,在科技部网站都可以查询到结果。通过科技部网站,便能找到相关数据,为研究提供一定的支撑。
之所以说是支撑,是因为在研究过程中还要借助海内外临床试验公示平台,进行验证。因为科技部服务平台公布的数据,仅有该临床试验的第三方实验室名单,没有具体的检测项目,无论伴随诊断还是MRD检测,都会归在其中。如下图所示,单看这一临床审批,并不清楚检测项目的具体类别。
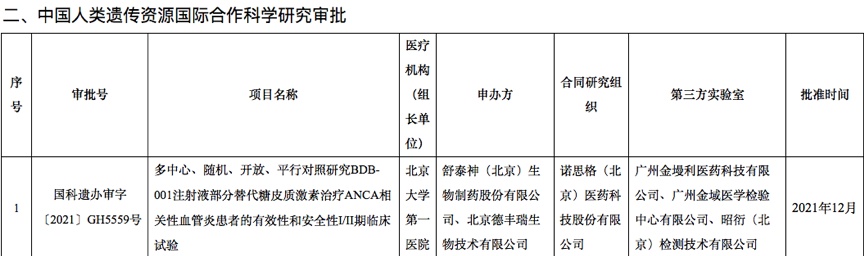
临床试验公示平台则相反:往往只公布临床检测项目内容,而不公布合作伙伴。两个平台的数据相结合,可以起到“闭环”验证的作用。
比如前文提到的天境生物临床试验。可以看到,金域医学(603882)以第三方实验室合作伙伴的身份出现在在科技部的审批结果名单中,结合临床试验所需的检测项目,大致可以判断金域医学是为天境生物提供MRD检测服务。
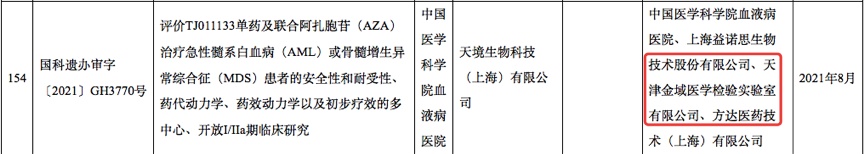
不过,要想找到更全的数据,国内临床公示平台远远不够。因为个别临床项目,即便有MRD检测产品也未必会披露。
不少临床试验由海外巨头发起,这些海外巨头在国内披露的临床信息,或许不如海外公示平台详细。如果漏掉这一环,会导致评价维度的不全面。
比如,根据科技部11月份的审批公告,可以看到,辉瑞开展的BCMA双抗三重难治性骨髓瘤临床试验中,第三方实验室中包括泛生子。
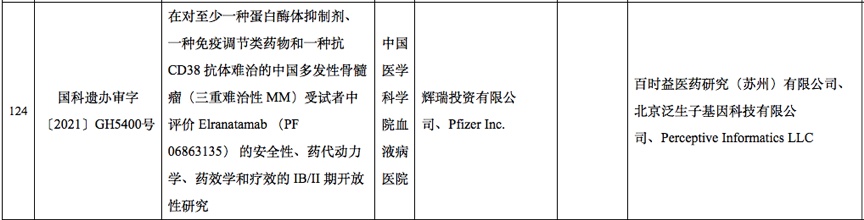
但由于国内临床信息披露有限,无法判断泛生子在该临床中的作用,究竟是基因检测还是MRD检测。

这时候,如果能够结合海外临床信息,便可以大致判断,泛生子在该临床中起到的作用是MRD检测。
辉瑞在clinicaltrials.gov披露的同适应症临床试验信息中,披露了更详细的次要终点信息,包括“最小残留疾病阴性率”,明确表示需要每12个月评估一次。

考虑到这两个临床进展差异不大,实验设计也基本相同,所以泛生子在上述临床中的作用也就不言而喻了。
这个例子说明,尽管略有繁琐,但要想判断MRD玩家的实力,结合海外信息必不可少。上文提及,判断实力玩家的维度,除了合作伙伴数量,还有质量。
仍以泛生子为例,如果没有结合海外信息,根据科技部和国内临床平台披露的信息,得出的结果是,其合作方仅是国内的康方生物、艾欣达伟和明聚生物等玩家。虽然数量不少,但缺少了海外巨头,“质量”维度难免要打折。
对任何一个基因检测玩家来说,能与辉瑞、强生等海外大药厂开展合作,都是其实力的有力佐证。

反过来,对于一些宣称自身技术过硬的基因检测公司,如果通过上述各平台检索下来,并不能看到它们的合作伙伴信息,又或者数量不多、质量不高,那就要斟酌一番了。
显然,要想发现真正的实力玩家,需要一双慧眼。
/ 03 /
从当下预见未来:
谁是最终王者?
通过科技部网站发布的信息,我们能够判断谁在血液瘤MRD领域更受药企欢迎不假,借此猜想终局也不难理解。
从目前来看,血液瘤MRD产品会率先发展。而受到药企欢迎的产品,某种程度上也说明其产品具有性能等综合优势。因此,这些产品在血液瘤MRD检测领域脱颖而出,不会让人感到意外。
但这与行业终局,似乎关联不大。毕竟,整个MRD检测市场,前景最大的是实体瘤MRD检测。因为超过90%的肿瘤患者都是实体瘤。
眼下,各家的实体瘤MRD产品基本都还处于更早期阶段。实体瘤MRD产品的检测原理和难度,与血液瘤完全不同。所以,即便某个基因检测玩家的血液瘤MRD产品实力突出,但这与实体瘤领域,并没有必然联系。
听上去没错,但也不完全对。关于这一点,我们需要先明白,实体瘤MRD检测产品的核心竞争力是什么?
答案不难回答:性能突出、便宜好用,当然还有一点,研发进度领先。所有医疗产品的竞争力基本都是这三点,关键在于如何做到。
实体瘤MRD检测产品要做到这三点难度极大,尤其离不开一个关键的角色:数据。
先来看性能。任何一款基因检测产品性能的提升,都需要大量的样本数据来验证。对于实体瘤MRD检测来说更是如此。因为实体瘤治疗后能够释放到血液中的标志物含量非常有限,这就要求检测产品十分灵敏,同时还必须避免过于灵敏把噪音认成信号导致假阳性。只有在大量真实临床数据的支持下,检测算法找到的平衡点才更接近最优解。
再来看研发进度。MRD检测产品,最终需要长期跟踪,明确知道每一个样本患者是否复发,这是一个长周期的过程。即,如果想要快速推进实体瘤MRD检测产品的研发,不仅对一个时间切片上的横向数据有要求,更对长时间尺度的数据积累有明确要求。
最后是成本。实体瘤MRD检测产品成本的下降,更加离不开数据。
实体瘤MRD检测产品研发的难点之一在于,实体瘤突变靶点较多,很难有一款产品可以做到全面筛选。当前的MRD检测产品,主要走高端定制化路线:首先通过WES全外显子检测,去确定肿瘤患者基因突变的靶点,然后再设计相应的产品去持续跟踪。定制化的产品,成本必然不会太低。
而MRD检测产品要想实现价格“亲民”,离不开产品标准化。标准化的关键则在于,找到适应症患者突变位点的共性,尽量排除患者间异质性影响,在可控的成本、有限的检测位点下对患者做到尽量全面的覆盖。实体瘤MRD产品的标准化是否能做好,很大程度上受制于是否有多维度、长时间、大规模的临床数据积累。
综上不难看出,实体瘤MRD检测产品护城河的构建,都指向了“数据”这一关键要素,而这正是药企的核心资产。因此,基因检测玩家要想攻克实体瘤,离不开药企的帮助。从近期公开的泛生子与阿斯利康实体瘤MRD合作来看,其合作重点之一便是利用检测公司的技术与药企的临床样本积累,达到1+1>2的效果。这种模式在未来实体瘤MRD产品开发中可能成为主流。
肿瘤早筛巨头Grail入局MRD领域的标志,便是与安进、阿斯利康以及百时美施贵宝达成战略合作协议。这也进一步证实了,合作伙伴对于MRD玩家的重要性。
对绝大部分基因检测玩家来说,虽然血液瘤的产品性能,不能平移到实体瘤,但依靠血液瘤建立的“朋友圈”的价值是巨大的。
谁能在当下得到更多药企的信赖,意味着在实体瘤MRD检测产品的开发,也能得到更多药企的支持。
这将助力其实体瘤MRD检测产品的开发,使得在整个MRD检测领域的竞争中,更容易构建自身的护城河。
免责声明:本文(报告)基于已公开的资料信息或受访人提供的信息撰写,但读懂财经及文章作者不保证该等信息资料的完整性、准确性。在任何情况下,本文(报告)中的信息或所表述的意见均不构成对任何人的投资建议。
本文首发于微信公众号:读懂财经。文章内容属作者个人观点,不代表和讯网立场。投资者据此操作,风险请自担。
(王治强 HF013)
