中新经纬4月6日电 6日,开拓药业公布新冠病毒治疗药物普克鲁胺治疗轻中症非住院新冠患者III期临床试验的关键数据结果。数据显示,普克鲁胺能够降低住院、死亡率、新冠病毒载量并改善相关新冠症状。
此前2021年12月,开拓药业曾公布普克鲁胺治疗轻中症非住院新冠患者III期临床试验中期进展,并表示未达到统计学显著有效,将调整临床试验方案。由此,不少人将此次结果定义为“反转”。
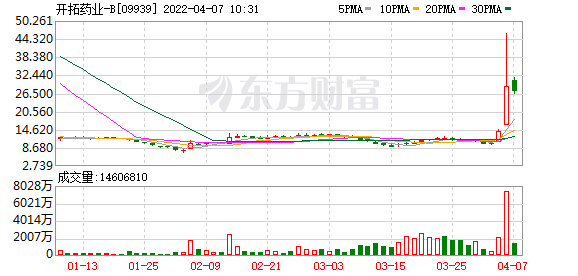
“反转”之下,开拓药业6日盘中涨超200%,截至当日收盘,报每股28.85港元,涨106.37%。不过,受访专家表示,从披露数据到普克鲁胺真正实现商业化,开拓药业仍需面对许多问题。
临床试验按原方案完成
对于“反转”,开拓药业回复中新经纬称,一方面,本次公布临床数据的试验就是此前中期分析数据,由于事件数较少未达到统计学显著性的临床试验(NCT04870606)。
2021年12月,开拓药业曾公布NCT04870606临床试验的中期分析结果,由于事件数较少未达到统计学显著性的试验。独立数据监察委员会(IDMC)建议开拓药业拓展高风险人群,这样更容易做出统计学差异。
“媒体对于此前中期分析结果存在误读,此前中期分析结果并不能代表临床宣告失败。”开拓药业表示。
NCT04870606是一项双盲、安慰剂对照(1:1)、随机、全球多中心的注册性临床试验,自2021年4月24日开始全球首位受试者入组,于2021年12月24日完成全球733名受试者入组(其中727名来自美国,其余来自其他国家),并于2022年2月3日完成最后一名受试者末次访视。
根据公告,该临床试验入组的受试者为首次出现新冠症状不超过5天,无论是否伴有风险因素,以及不排除接种过新冠疫苗的受试者。
此前,在中期分析结果出炉后,开拓药业称,公司计划调整临床试验方案并寻求获得美国食品药品监督管理局等监管机构的同意,继续招募只有基础性疾病和/或无新冠疫苗接种史的高风险新冠患者。
但从实际执行中,开拓药业表示,由于中期结果公布时患者临床试验招募已经完成,综合多方面考量,公司决定按照原方案完成这一临床试验。而在另一项正在进行的针对轻中症非住院患者的III期临床试验(NCT04869228)中进行修改,拓展纳入高风险人群。这一更新已与CDE(国家食品药品监督管理局药品审评中心)沟通并获同意。
专家:临床药效存疑
根据开拓药业公告,普克鲁胺可有效降低新冠患者的住院/死亡率,特别是对于服药超过7天的全部患者,相应保护率达100%。
汕头大学病毒学教授常荣山对中新经纬分析,如果从试验入组截止时间即2021年12月24日来看,彼时主要流行毒株为伽马与德尔塔,而奥密克戎于2021年11月26日才被世界卫生组织定义为第五种“关切变异株”,由此病例纳入可能有限。
开拓药业回应称,患者招募后期感染毒株为奥密克戎,彼时奥密克戎在美国已有流行趋势,但具体的数量和比例,还需要等到最终详细的临床报告。
对于开拓药业公布的临床试验结果,某医疗行业从业人员对中新经纬表示,该临床试验结果很有说服力,从机理来看,普克鲁胺能显著降低ace2和蛋白切割酶的表达量。
但另一方面,香港大学医学院生物医学学院教授、病毒学家金冬雁对中新经纬分析称,开拓药业普克鲁胺临床试验的样本量有限,对于药效支撑力度明显不足。“此外,试验设计也有问题,很难获得明确结论。700多人入组,对照组死亡1例,用药组没有死亡,或者对照组住院8例,用药组住院4例,无论以常识判断或者进行统计学分析,以这样的数据想在中国或美国取得紧急批准的可能性较小。”金冬雁说。
作用靶点与辉瑞Paxlovid不同
此外,普克鲁胺面临的另一大争议在于药物靶点。新冠抗病毒药物大致有两种类型,包括辉瑞的Paxlovid、默沙东的Molnupiravir、吉利德的Remdersivir、君实的VV116都属于主蛋白酶或复制酶抑制剂。
而普克鲁胺是一款雄激素受体(AR)拮抗剂,也是ACE2和TMPRSS2降解剂。根据开拓药业此前披露的招股书,普克鲁胺正在进行用于前列腺癌和乳腺癌治疗的临床试验。疫情暴发后,研究人员认为,普克鲁胺对于轻中重症新冠患者均有较好的疗效。
由此,普克鲁胺属于“老药新用”。“在新冠病毒刚发现半年之内,全世界科学家对过往的小分子药物进行了大量试验,这些药不能称为‘特效药’。之后,很多‘老药新用’的临床试验都失败了,虽然部分临床效果还可以,但毒性太大。从临床效果来看,3CL蛋白酶抑制剂仍是抗新冠病毒的最佳靶点。”常荣山说道。
从药物原理出发,金冬雁表达了对激素类药物广泛使用的担忧。“普克鲁胺是激素类药物,是雄激素受体抑制剂。首先,没有确凿证据证明新冠感染是因为雄激素的作用;其次,激素类药物在临床试验是被严格管控的。对于大量的奥密克戎轻症患者,感染引起的疾病是自限性自愈性,不需特别医疗照护,也不应提供过度医疗。在这批人中使用激素类药物有可能反而‘弊大于利’。”金冬雁说。
通过紧急授权仍有距离
2020年11月,国家药品监督管理局药品审评中心发布《药品附条件批准上市技术指导原则(试行)》,其中表示,附条件批准上市是指用于严重危及生命且尚无有效治疗手段的疾病、公共卫生方面急需的药品,现有临床研究资料尚未满足常规上市注册的全部要求,但已有临床试验数据显示疗效并能预测其临床价值,在规定申请人必须履行特定条件的情况下基于替代终点、中间临床终点或早期临床试验数据而批准上市。
2月11日,据国家药监局,按照药品特别审批程序,辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)获得附条件批准,这是全世界首款在中国获得紧急授权的用于新冠治疗的小分子口服药。
在公布三期临床数据后,开拓药业表示,目前正积极推进向中国、美国及其他国家和地区的药物监督机构申请紧急用药EUA许可。
不过,常荣山表示普克鲁胺离通过紧急授权仍有距离。在三期临床数据公布后,获得紧急授权之前,专家组会对药物进行审议,而目前,开拓药业还没有进行同行评价。其次,专家有可能要求开拓药业补交普克鲁胺对于奥密克戎的临床试验结果。最后,即使最终能获得紧急授权,能否投入商业化也仍是未知数。
中新经纬注意到,开拓药业已经在推动普克鲁胺的商业化进程。2021年7月,复星医药宣布与开拓药业达成合作,获得普克鲁胺在印度和28个非洲国家的独家注册和商业化销售权益,并支付开拓药业不超过5.6亿元。
此外,根据开拓药业2021年全年业绩报告,目前普克鲁胺的月产能达到100万人份,预计年产能可以达到5000万人份。
(文章来源:中新经纬)
文章来源:中新经纬
