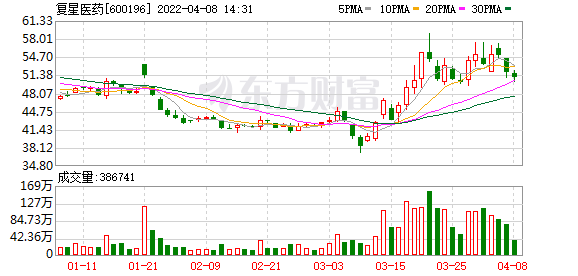
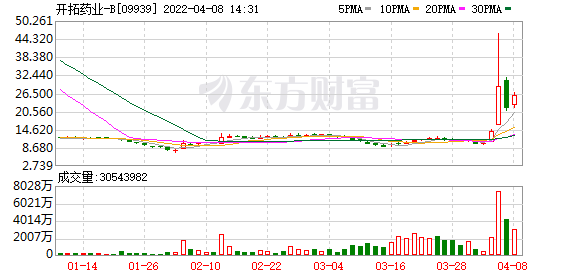
4月6日,开拓药业-B(09939.HK)公布其新冠治疗药物普克鲁胺在III期临床试验完成,相关条件下,受试患者达到100%的保护率。当日盘中暴涨229%后,次日以大跌24.783%收市。截至4月8日午盘,开拓药业涨15.21%,报25港元/股。
普克鲁胺被寄予首个国产新冠口服药的厚望。红星资本局注意到,虽然受试者100%保护率,并不代表患者就能被100%治愈,在尚未批准上市的情况下,复星医药(600196.SH;02196.HK)早已瞄准其市场价值,提前拿到了普克鲁胺的独家注册和商业化销售权益,并为此支付5.6亿元。
4月8日,红星资本局就相关试验情况联系到开拓药业,但对方婉拒了采访。
国内首个公布III期临床试验结果
的新冠口服药
4月6日,开拓药业公布新冠病毒治疗药物普克鲁胺治疗轻中症非住院新冠患者III期临床试验的关键数据结果。结果显示,在完成服药大于7天的受试者以及伴有高风险因素的中高年龄受试者达到100%保护率。
公告还指出,普克鲁胺能够降低住院、死亡率、新冠病毒载量并改善相关新冠症状。

截图自开拓药业公告
早在2021年4月24日,开拓药业就开始了全球首位受试者入组。2021年12月24日,完成全球733名受试者入组(其中727名来自美国,其余来自其他国家)。
2021年12月27日,开拓药业公告称,普克鲁胺III期临床试验的中期分析未达到统计学显著性,而进行该试验的目的是评估普克鲁胺治疗非住院新冠患者有效性和安全性。本公司将向各监管机构,包括美国食品药品监督管理局(FDA)寻求同意以修改临床试验方案,计划继续招募只有基础性疾病、无新冠疫苗接种史的高风险新冠患者。
次日,开拓药业在开盘前紧急召开了电话会议,解释该临床试验仍然验证了普克鲁胺的安全性,但公司28日股价仍跌超70%以上,市值蒸发百亿港元。
尽管开拓药业在公告中称将修改临床试验方案,但据多家媒体报道,开拓药业方面曾回应称,由于中期结果公布时患者临床试验招募已经完成,综合多方面考量,公司决定按照原方案完成这一临床试验。开拓药业还表示,“媒体对于此前中期分析结果存在误读,此前中期分析结果并不能代表临床宣告失败。”
直至2022年2月3日,最后一名受试者末次访视完成。
过去一年的时间,开拓药业股价也随着临床试验进展一波三折,但不可否认的是,普克鲁胺仍被视为继辉瑞新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)获得附条件批准后(2022年2月11日),首个最有可能的国产新冠口服药。
普克鲁胺系意外发现可治疗新冠
原本用于治疗前列腺
公开资料显示,开拓药业成立于2009年,在登陆港交所之前,曾于2016年挂牌新三板。开拓药业官网显示,其管理团队不乏来自辉瑞、默沙东、药明生物等企业的科学家、高管。
公司主要致力于AR(雄激素受体)相关疾病和肿瘤领域,以及新冠、前列腺癌、乳腺癌、肝癌、脱发和痤疮等缺乏有效治疗手段、且发病人群基数大的癌症及其他疾病领域。产品线上则主要包括小分子创新药、生物创新药及联合疗法。
普克鲁胺被发现能降低新冠患者住院率和死亡率,其实源于一次意外发现。在被定义为“首个最有可能的国产新冠口服药”之前,普克鲁胺在前列腺癌治疗中拥有显著的临床价值。
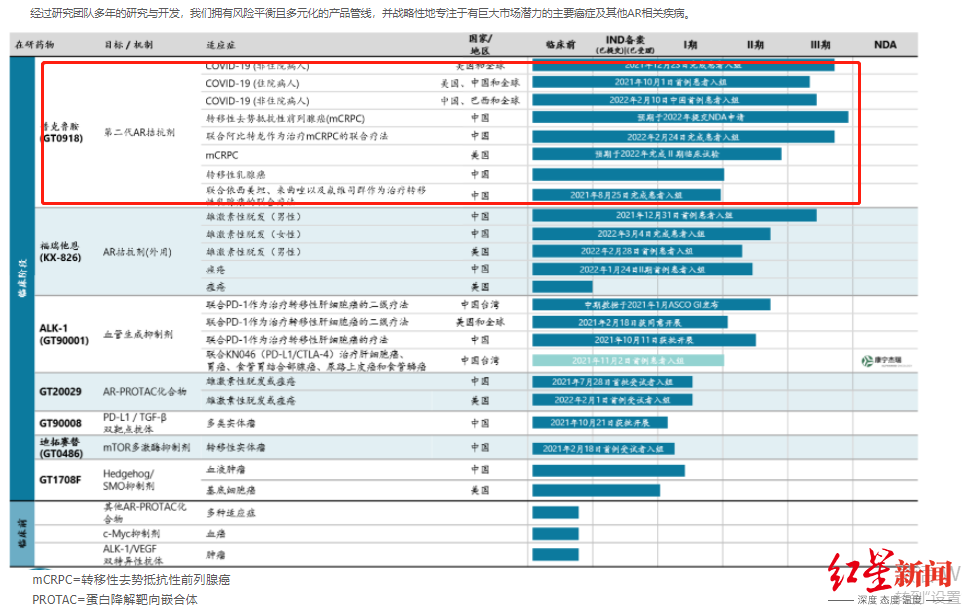
开拓药业包括普克鲁胺的在研产品,图据官网
普克鲁胺还未批准上市
复星医药早已提前布局
虽然普克鲁胺还未在国内批准上市,但复星医药(600196.SH)早已嗅到商机,拿下了其海外销售权益。
2021年7月,普克鲁胺在巴拉圭获得了紧急使用授权(EUA),用于新冠住院患者的治疗。与此同时,开拓药业公告称,与复星医药子公司——上海复星医药产业发展有限公司(下称“复星医药产业”)就普克鲁胺治疗新冠,在多个国家的商业化达成合作协议。
复星医药产业将获得普克鲁胺在合作区域的独家注册和商业化销售权益,开拓药业可收取不超过5.6亿元的首付款。
开拓药业年报显示,公司目前仍处于亏损状态,2019年-2021年分别亏损2.33亿元、5.08亿元以及8.42亿元,累计亏损约15.83亿元。
按近三年的累计亏损数值来看,复星医药支付的独家注册和销售费用,基本可以覆盖公司一年的亏损。
值得一提的是,从其最新的2021年报来看,公司研发成本由2020年度的3.29亿元增加至2021年度的7.68亿元,增长率133.5%,主要就是由于集团于报告期间发起及进行的三项用于治疗COVID-19的普克鲁胺实验。
输出之外,开拓药业也有引进。2018年1月,公司宣布,辉瑞将授予开拓药业在全球范围内独家开发、生产和商业化一款抗肿瘤抗体新药的权利。这是辉瑞在肿瘤领域首次授权中国本土企业抗体新药的开发权。该药也将有望成为全球首个针对活化素受体样激酶-1(Activin receptor-like kinase-1,ALK-1)靶点的全人源单克隆抗体治疗性药物。
释疑:保护率100%
不代表100%治愈,更是起控制作用
但是,普克鲁胺并未给市场带来一个确定的预期。
仔细研读公告可以看到的是,上述III期临床试验的参与者为“轻中症非住院新冠患者”。而公司另一项正在进行的,针对轻中症非住院患者的III期临床试验(NCT04869228)进行修改后,拓展纳入高风险人群的试验结果还未可知。
事实上,服用普克鲁胺大于7天的受试者达到100%保护率,并不代表100%治愈,更多的是起到控制的作用。
(注:保护率是指对照组与实验组发病(或死亡)率之差占对照组发病(或死亡)率的比例。表示实验因素对发病(或死亡)的影响。常用百分率(%)表示。)
四川大学某药学研究员向红星资本局解释了何为100%保护率,“相较于没服用普克鲁胺的新冠患者,服用了的患者没有出现住院或者死亡。”“没有出现住院或者死亡,虽然不代表治愈,但能控制住病情不恶化,也是能说明这个药对新冠病毒有效的。”
相对于口服药的尚无明确的保护率指标,世卫组织认为,新冠疫苗的保护率在50%以上就可以批准上市使用,可以在人群中形成有效的免疫屏障,阻断传染病的传播。但即便如此,世卫组织也建议新冠患者使用口服药。
3月4日,参考消息引述法新社报道,由美国默克制药公司研发的莫纳皮拉韦口服药,在出现新冠肺炎症状后尽快服用,连服5天,可以降低住院风险。世卫组织专家小组曾在《英国医学杂志》上表示,建议免疫系统薄弱者或慢性病患者在罹患非重症新冠肺炎时口服该药。
但报道也称,没有太多迹象表明该药会降低死亡率,每1000名患者中死亡人数仅减少6人。
(文章来源:红星资本局)
文章来源:红星资本局
