4月24日,上海浦东新区的康先生向上海证券报记者反映,23日晚由街道统一免费配发的抗原检测试剂产品中,采样器里竟然夹杂着一根头发。康先生第一时间告诉了楼长,当晚楼长根据街道通知,全部收回该批次的抗原检测产品。
据查,上述抗原检测产品的生产商是艾康生物技术(杭州)有限公司(简称“艾康生物”)。
同样在4月23日,有上海网民反映:“请暂时停止用街道之前发的抗原在家自测;厂家检出了阳。”配图正是艾康生物生产的“艾科”品牌抗原检测试剂盒。对此,艾康生物发布严正声明表示:“目前我司Flowflex艾科新型冠状病毒(2019-nCoV)抗原检测试剂盒(乳胶法)生产正常,全体员工同心抗疫,疫情防控等各项工作均有序开展。我司保留采取法律措施依法维护我司合法权益的权力。”

严正声明言犹在耳,“问题产品”又起风波。究竟是巧合,还是警报?一根头发背后,是否还隐藏着更大的风险和隐患?对此,上证报记者多方采访、展开调查。
艾康生物:采样器是外购的,
不会对其进行检验
24日下午,记者与康先生连线获得了“问题产品”相关照片、视频。这是由艾康生物生产的25人份/盒的新冠抗原检测试剂(生产批号:202204085),生产日期是2022年4月6日。盒内的检测产品主要包括:检测卡、提取管(内含裂解液)、采样器(又称“采样拭子”“取样器”)等。
头发就出现在采样器中。

上海某小区发放的采样器里竟然夹杂着一根头发
上证报记者随即拨通了艾康生物售后服务电话反映了相关情况。一位售后人员表示:“这个产品(采样器)是外购,可能需要问一下供应商那边。这个不是我们自己生产的。”
据售后人员介绍,除采样器是外购的之外,裂解液一部分是自产,一部分也是外购,只有抗原检测试剂中的检测卡是由艾康生物生产的。
上证报记者注意到,采样器的生产商是大连美佳科技有限公司(简称“大连美佳”)。
对于双方何时建立供应关系,供应商的资质、生产环境等是否有做过实地调研等问题,该售后人员表示:“合作细节没办法回答,属于采购部门管理。但是我们对供应商是有挑选的,毕竟作为头部抗原生产企业,我们对供应商还是有要求的,这个事件我们已经录入投诉系统,会查下去的。具体还要他们那边调查了,我们才能得到结论。”同时,售后人员建议直接联系大连美佳更快捷的获得结果。
令记者不解的是,即使是外购产品,采购回来后难道不需要验货,再经过一道质量检验进行把关吗?作为抗原检测试剂盒一整套的产品,检测卡、提取管(内含裂解液)、采样器统一包装入盒时,艾康生物难道也没有相应的把关程序了吗?
“是分开发的,我们不会再做检测,因为行业不一样,我们没办法做这个事情。”
艾康生物方面如此回答。
有市民质疑,采样器是直接伸进鼻子、喉咙进行取样的,疫情期间每天都与我们“亲密接触”,为何会出现头发?生产、包装、出厂到底有没有规范的质量检验?
公开资料显示,艾康生物是外商独资生物技术公司,公司成立于1995年,是陆续通过中国GMP、欧洲CE、 ISO13485三大国际权威认证的生物诊断公司。公司注册资本950万美元,法定代表人、董事长、总经理为蒋萍。

再看司法风险情况,自2015年以来,艾康生物累计涉及32起案件。
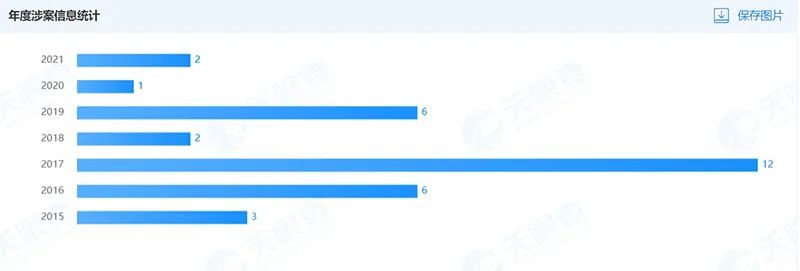
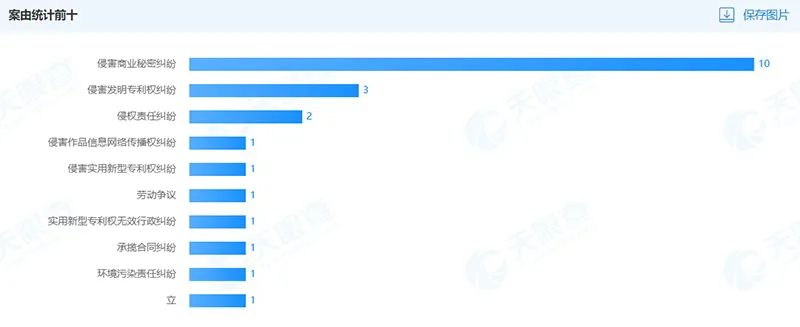
案件类型包括侵害商业秘密纠纷、侵害发明专利权纠纷等。
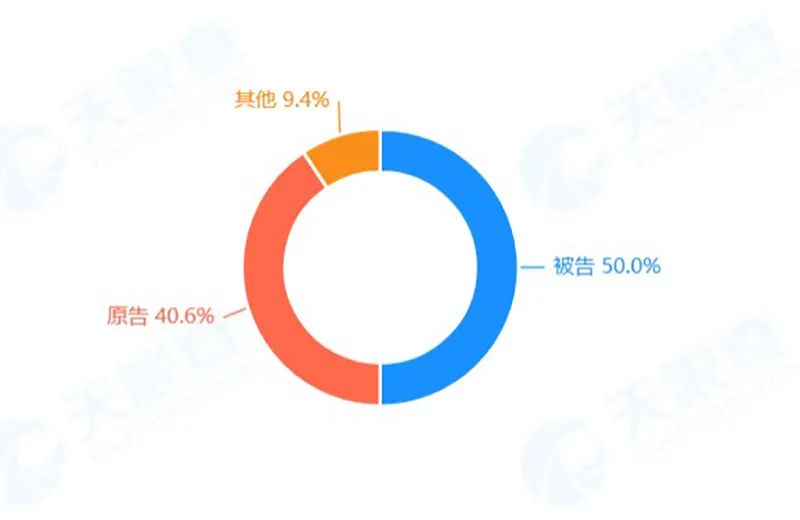
其中,公司作为被告的案件达到50%。
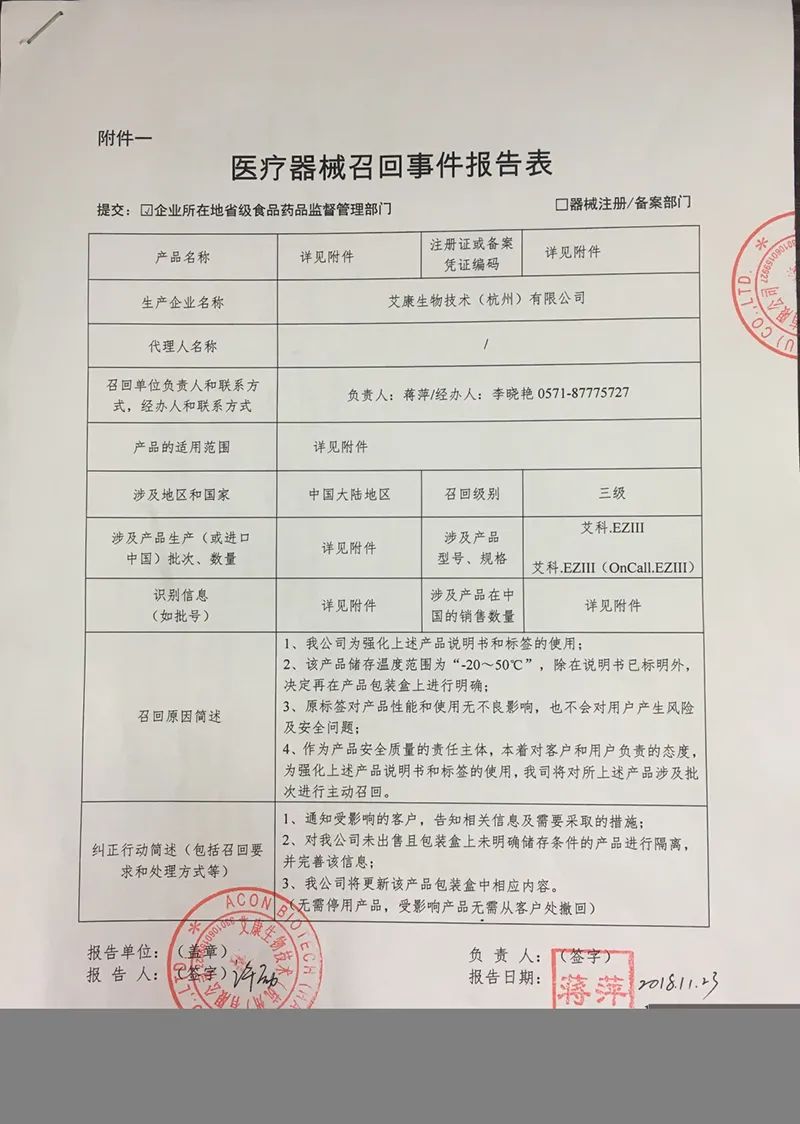
此外,记者还发现,公司在2018年有一起产品召回事件。
艾康生物当时报告显示,由于在国家医疗器械质量监督抽验中产品外包装盒缺少运输贮存条件,艾康生物技术(杭州)有限公司对其生产的艾科血糖测试系统[注册证号:浙食药监械(准)字2009第2400076号;浙食药监械(准)字2010第2400339号;浙食药监械出(准)字2011第2400125号]和血糖测试仪(注册证号:20152400020)主动召回,召回级别为三级。
大连美佳:电话号码欠费停机
作为采样器的直接生产商,大连美佳情况又是如何?
24日,记者获得一份大连美佳4月13日对“使用单位”的情况说明显示:“我们公司生产的一次性使用采样器产品备案号:辽大械备20220001,产品质量稳定,符合临床使用要求。”

然而,“问题产品”正是该备案号产品。

上海某小区发放的有头发的采样器包装背面
在情况说明的结尾处留有联系电话,记者拨打过去听到的竟是:“您拨打的用户已欠费停机。”记者再次拨打天眼查公示的工商登记资料中的座机号码,则被提示:“号码不存在。”
这究竟是一家怎样的公司?
据了解,大连美佳科技有限公司成立于2014年8月,注册资本为1200万元,法定代表人、董事长为于春桥。公司经营范围包括道路货物运输(不含危险货物),第二类医疗器械生产、销售,第一类医疗器械生产、销售,产业用纺织制成品制造等。今年1-2月,于春桥旗下2家公司陆续对公司进行增资,将注册资本从200万元增至1200万元。

公开信息显示,2017年以来,大连美佳共涉及2起行政处罚。去年4月,公司因建设项目没有安全设施设计,被处罚金2.8万元。

行业专家:
是否“无菌生产”因企而异
记者从国家药监局获悉,3月份国家药监局共批准注册了24家公司的新冠抗原检测产品,其中就包括艾康生物。
记者对比多家公司产品发现,采样器大部分都是外购,除供应商不同之外,采样器的生产标准也有不同,分为“无菌”“非无菌”两类。

而大连美佳的采样器就是在“非无菌”状态下生产上市的。那么“无菌”“非无菌”两类采样器有何不同?
有抗原检测试剂生产厂商负责人告诉记者,医疗器械注册通常分为三类,三类级别最高,二类次之,再者是一类。目前采样器既可以按照二类,也可以按照一类进行注册,区别则是二类医疗器械,出厂需要达到无菌要求,而一类医疗器械没有相关要求,可以“非无菌”“未灭菌”状态上市。
“每家企业的选择不同,我们企业自身有一类医疗器械资质,没有二类医疗器械资质,出于对无菌产品更高的质量要求,公司还是选择采购二类医疗器械厂家的采样器。同时,我们的产品最早是出口国外的,国外认证的产品必须是灭菌的,所以国内申报时我们也沿用了这一标准。”上述厂商负责人表示。
此外,“无菌”“非无菌”两类产品的生产成本差异,可能也是企业考虑的重要因素。
此前,上海医疗器械审评专家也向媒体解释称,“无菌”是指无存活微生物的状态,标示“无菌”的医疗器械经过灭菌,其存在存活微生物的理论概率应不超过10的负6次方,所以在一些要求特别高的使用环境下,才需要“无菌”医疗器械。“非无菌”“未灭菌”医疗器械虽然无法严苛到像“无菌”医疗器械那样几乎“一菌不染”,但也不至于“藏污纳垢”。所有医疗器械都必须满足一定的卫生要求,比如严格控制微生物的数量,才能够合格上市。
记者也注意到,目前市场上各类采样器产品,大部分还是“非无菌”生产。
专家进一步提示,只要使用来自正规渠道的合格产品,关于“非无菌”的担忧是没有必要的。如果市民领取到疑似包装破损、已被污染的采样拭子,请直接按相关要求丢弃。
截至记者发稿,大连美佳多个公开电话仍处于失联状态。艾康生物也没有给出最新回复。康先生所在的街道已经重新下发了另一家厂商的抗原检测产品,不过原计划昨天进行的抗原检测,最后并未进行。
抗原检测是此次上海防疫的重要手段之一,产品分发的每个环节都关系着公众健康,考验着每一个厂商的底线和良知。只有不放过任何一个细节、不留一点安全隐患,才能让公众安心、放心、舒心。
(文章来源:上海证券报)
文章来源:上海证券报
