今年5月10日,科济药业-B(02171)发布公告,其重磅产品CT041的研究者发起试验的期中分析结果在Nature
Medicine上发表。结果显示,CT041整体耐受性良好且安全性风险可控。
在积极的研发成果带动下,科济药业次日股价收涨6.52%,并正式开启为期2个月的主升浪。之后的7月份,科济药业的股价虽随恒指大盘趋势向下,但自5月以来,南下资金持续抄底,持仓占比一路攀升,由5.12%增至9.11%,最终量变引发质变。
智通财经APP观察到,科济药业股价在8月份逆市迎来一波反弹,并在8月26日将最高股价定格在每股20.65港元,较5月10日的最低点9.68港元上涨113.32%。
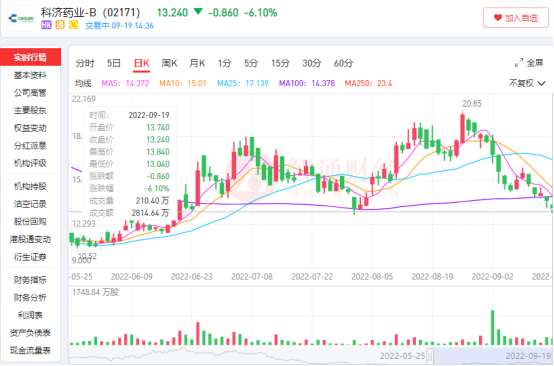
不过随着科济药业股价来到近5个月以来的新高,也正式宣布这轮中期业绩炒作迎来尾声。自8月29日起,科济药业股价一路向下,截至9月19日已跌至最低13.04港元,15个交易日内较最高点回落36.85%。
从科济药业的这轮股价起伏来看,市场对公司的估值评判锚点依然较为清晰,公司股价上涨主要靠阶段性披露的研发成果驱动。在尚无针对实体瘤的CAR-T产品上市的当下,其CT041作为全球首个且唯一进入到确证性Ⅱ期临床试验的实体瘤CAR-T细胞候选产品,其研发进度显然会受到二级市场重点关注。而此次发布的中期业绩,正是一个不错的窗口。
阶段性研发成果带来的驱动力
从此次科济药业披露的财报来看,其中有一个被众多投资者关注的数据“净亏损同比收窄91.43%”。财报显示,科济药业于报告期内取得净亏损3.76亿元(人民币,下同),同比收窄91.43%。这一数据也被解读为公司财务状况转好,但事实并非如此。
智通财经APP观察到,2021年上半年,科济药业期内净亏损高达43.94亿元,原因在于其当期出现了高达41.56亿元的巨额公允价值变动损益,但这并不影响公司当期的经营,且科济药业的2021年年报数据也受到该因素影响。实际上,科济在2021年中报的经调整净亏损仅有2.10亿元。

由此,今年公司中期的经调整净亏损达到3.53亿元,其实较上年同期出现了进一步扩大,同比增长67.84%。但从消息面来看,早在7月22日,科济药业发布中期业绩盈警时便提及了这一点,但并未影响公司在8月初的股价涨幅。可以看到,市场的关注点依旧放在公司的研发投入和核心产品的研发进度上。
从费用端来看,科济药业经调整净亏损扩大的主因也是研发投入增长。今年上半年,公司研发开支达到3.16亿元,较上年同期增长79.55%。
从研发进展来看,当前科济药业科济药业已自主开发了12款差异化候选产品,其中包括11款CAR-T细胞疗法和1款mAb产品,涵盖常规型、新一代CAR-T技术及同种异体疗法,并已在中国、美国和加拿大获得8项CAR-T产品的IND许可。

其中,CT053作为科济药业的一款靶向BCMA用于治疗复发/难治多发性骨髓瘤(R/R
MM)的自体CAR-T细胞核心候选产品,在今年上半年,已完成在中国进行的关键II期试验(LUMMICAR STUDY
1)的患者入组;并已在北美关键2期临床试验(LUMMICAR STUDY 2)中治疗了首例患者。
此外,公司计划于2023年向美国食品药品监督管理局(FDA)提交生物制剂许可申请(BLA),且计划进行其他临床试验以开发CT053作为多发性骨髓瘤的早线治疗方法。
与此同时,科济药业的另一款潜在全球同类首创的靶向Claudin18.2蛋白的自体CAR-T细胞候选产品CT041在今年上半年的2022
ASCO年会公布的临床结果中展现了其显著的疗效与安全性。

其中,在美国进行的一项针对晚期胃癌和胰腺癌患者的多中心1b期试验的结果显示,在经历过多线治疗的胃癌患者中,CT041可能有显著的抗肿瘤活性改善(客观反应率
(ORR)为57.1%,21.4%表现为SD,DCR为78.6%,mPFS和mOS分别为5.6个月和10.8个月)。
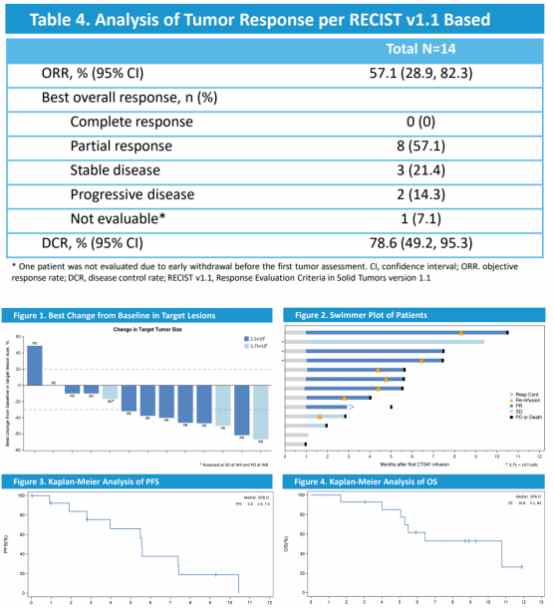
而在中国进行的另一项Ib/II期CT041试验结果中显示,在接受过治疗的晚期胃癌/食管胃结合部腺癌患者中,CT041具有可控的安全性/耐受性和有前景的抗肿瘤疗效。
目前科济药业在美国已完成CT041的剂量爬坡并已启动剂量扩展,计划于2022年下半年在北美启动一项2期临床试验,并于2024年向FDA提交BLA。此外,科济还计划于2024年上半年向中国国家药监局提交NDA。凭借以上研发进度,CT041也有望成为全球第一款获批上市的实体瘤CAR-T药物。
除了以上2款核心产品的研发进展外,今年上半年科济还在包括CT011、KJ-C1807、KJ-C2112和KJ-C2113等新一代CAR-T疗法,取得一定进展。值得一提的是,其中CT011在GPC3
CAR-T基础上加入了转录因子,加强了CAR-T在肿瘤中的驻留,表现出更强的抗肿瘤活性;KJ-C1807和KJ-C2113基于CycloCAR技术构建,该技术为CAR-T共表达IL-7和CCL21,可能具有更强的疗效,同时可以省去清淋的程序;KJ-C2112同样加入转录因子,增强抗肿瘤疗效。
然而,即便科济药业在细胞治疗实体瘤领域表现出众,但其仍然不是目前CAR-T长期投资领域的最优解。
CAR-T领域的挑战
临床速度是衡量企业研发实力的重要指标,早期临床实验是新药开发的开端,注册性临床代表正式迈入商业化研发的大门。实际上,除了科济药业外,国内众多创新药企在同领域研发进度上也在向公司发起冲击。
以传奇生物的anti-CLDN
CAR-T产品LB-1908为例,与CT041类似,目前两款CAR-T均对CLDN18.2具有较高的选择性,而两款产品主要不同点在于,CT041
的CAR为人源化scFv,共刺激域为CD28,而LB-1908的CAR为骆驼源VHH抗体,共刺激域由4-1BB组成。
值得一提的是,对于共刺激域4-1BB使用更为广泛,其作为共刺激分子时CAR-T安全性与持续性相对更好,而CD28
作为共刺激分子时T细胞在体内迅速增殖但持续性较短,可能导致治疗缓解持续时间(DOR)相对较短。因此,从作用机理来看,LB-1908存在一定优势。
从研发进度来看,今年6月3日,美国FDA批准了一项IND申请,以评估在美国进行的LB1908的I期临床试验;另外,一项由研究者发起的评估LB1908治疗晚期胃癌的I期临床试验在中国同步进行(NCT04467853)。
虽然从研发进度上,目前CT041国内研发进展仍处于领先地位,但包括LB1908在内的后来者挑战同样不容忽视。
除此之外,缩短生产时间、降低成本,提升可及性是细胞治疗产业化发展亟待解决的问题,但一直以来科济药业在此方面的研发便有所欠缺。
无论从财报还是此前的招股书,投资者可以清晰看到,目前科济药业的研发重心主要还是放在CT053、CT041等具有一定成熟技术的产品上,也就是说推动核心产品商业化是其主要目标。相较之下,譬如实体瘤增强型CycloCAR-T、通用型CAR-T疗法等产品研发则尚处临床前研究阶段。
相较之下,针对细胞疗法“体外制造”的卡脖子问题,诺华的T-Charge平台实现了2天便完成CAR-T生产,目前产品已进入临床阶段;国内亘喜FasTCAR技术平台实现次日完成CAR-T生产。此外,还有包括SANA公司Fusogen融合素技术、Umoja公司VivoVec递送平台,Ixaka公司TNPs技术等能够通过将CAR基因注入患者体内实现在体内制造CAR-T直接省去繁杂的体外制造过程,并且相关产品预计将在今年进入临床验证。
显然,科济药业与同行企业在现货型CAR-T研发上存在一定差距。而这或许意味着,虽然科济药业手握不错的实体瘤治疗产品,但受限于制备成本等因素,待产品上市后,公司产品售价或将成为其进一步市场拓展的“拖油瓶”。
从整体来看,目前包括产品已上市的CAR-T研发企业在内,全球范围内尚无一家企业能够完美解决CAR-T赛道生产成本和市场可及性的双重问题。虽然手握不错的实体瘤治疗产品,但科济若想成为CAR-T赛道的投资最优解仍任重道远。
