继英、美两地上市后,2021年6月和黄医药(00013)登陆港交所,开启三地上市。然而在港交所上市以来,和黄医药股价表现并不佳,上市以来股价累计跌幅近7成。
在今年股价跌跌不休中,和黄医药多次发布利好消息,如公司将在2022年ESMO年会上公布呋喹替尼(Fruquintinib)治疗难治性的转移性结直肠癌的FRESCO-2国际多中心III期研究数据总结;向3名雇员授出其认股权计划项下的认股权。然而公司的股价并未因此利好的消息上涨,反而在这些公告后继续下跌,截至9月21日收盘,公司股价跌4.71%,收16.2港元/股。

上半年营收超2亿美元,现金流吃紧
智通财经APP了解到,和黄医药成立于2000年,作为一家处于商业化阶段的全球生物医药公司,和黄医药专注于发现、开发及商业化治疗癌症及免疫性疾病的靶向疗法及免疫疗法。
在过去15年,和黄医药选择了肿瘤和免疫治疗两大领域,并且自有发现引擎已创建一系列产品管线,目前公司有3款产品在国内上市,索凡替尼(苏泰达)、赛沃替尼(沃瑞莎)、呋喹替尼(爱优特),第4种候选药物他泽司他已获批准于海南先行区上市使用。13种肿瘤候选药物在中国推进到临床试验,其中7种亦在美国和欧洲进行临床开发。
在肿瘤治疗领域,和黄医药选择了乳腺癌、胃癌、结直肠癌、胆管癌等实体瘤适应症;在靶点方面,和黄医药并没有选择十分火热的靶点,而是选择了MET、VEGFR1/2/3、PI3K等靶点。Syk抑制剂、PI3Kδ抑制剂、FGFR1/2/3抑制剂和IDH1/2双重抑制剂是和黄医药重点布局产品。
与港股生物医药板块众多未盈利公司不同,两票制之前,和黄医药收入主要来源于商业平台处方药业务,不过由于两票制等政策的影响,目前公司收入主要来源于创新药造血。
2022年上半年,受益于爱优特®、苏泰达®及沃瑞沙®的商业化推进,公司收入2.02亿美元,较去年同期增长28%。其中,爱优特®市场销售额为5040万美元,同比增长26%;苏泰达®市场销售额为1360万美元,去年同期为800万美元,苏泰达®销售的大幅增长主要得益于今年1月份首次纳入国家医保药品目录;沃瑞沙®为中国首个选择性MET抑制剂,受益于阿斯利康庞大的肿瘤团队的推广,上半年该药市场销售额为2330万美元。达唯珂®于今年6月在中国海南省成功上市,下半年有望为公司贡献部分业绩。
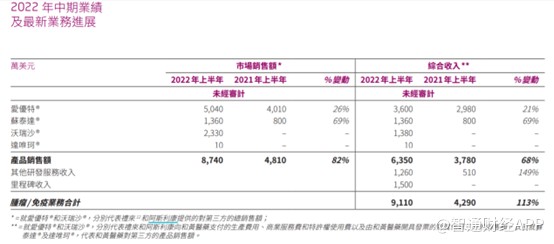
虽然和黄医药已有多款创新药产品商业化,但是自2017年以来,公司持续亏损,上半年亏损1.63亿美金。对此,和黄医药表示,导致公司亏损的主要原因为公司销售第三方处方药品产生的成本以及爱优特®、苏泰达®、沃瑞沙®的营销成本,这些成本合计高达1.373亿美元。
不仅如此,和黄医药进一步扩产创新肿瘤候选药物的研发,研发支出高达1.817亿美元,其中美国和欧洲的国际临床和法规事务团队产生8360万美元的开支,在中国的研发开支为9810万美元。
入不敷出带来的最大影响在于,公司现金流压力逐渐增加。从2018年到今年上半年。公司经营活动现金流始终处于净流出状态。也就是说,和黄医药当前的销售收入,远远不能满足其创新药的发展需求,而从融资现金流净额数据不难推断,公司研发投入的现金流,主要来自于从资本市场上融资获得,包括美国上市时融资、港交所上市时融资以及银行贷款融资循环贷款带来的现金流。
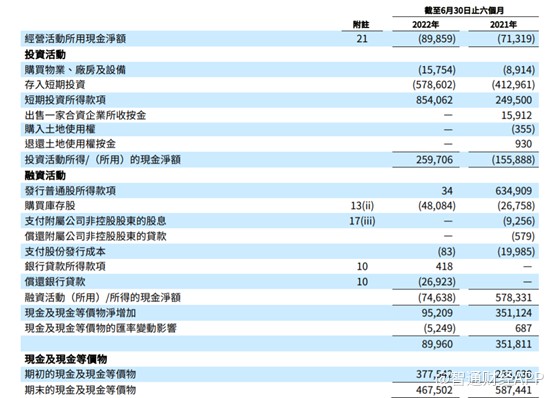
截至2022年6月30日,公司现金及现金等价物和短期投资合计为8.262亿美元,而2021年底为10.117亿美元,半年内花掉1.855亿美元,若公司产品没能贡献现金流的话,按此速度“烧钱”,这部分现金流也只够支撑2年半的时间。
商业化方面,上半年公司员工有820名,较2021年底增加190名,覆盖约3000家肿瘤医院和约30000名肿瘤科医生。
产能方面,为增加生产爱优特®、苏泰达®以及沃瑞沙®以满足商业供应,和黄医药启动安迪利塞及索乐匹尼布的新药上市申请的支持性研究,包括稳定性研究和工艺验证及上海新旗舰生产基地的建设继续按计划进行-该生产基地有望将和黄医药的创新药物产品生产能力提高五倍以上。设备的安装计划在2022年底完成,目标在2023年底获得药品生产质量管理规范(GMP)认证。
经不起推敲的三款核心产品
表面上,和黄医药已有三款创新药产品上市,但细究来看,其三款已上市的产品均经不起推敲。
先看其重磅产品赛沃替尼。智通财经APP了解到,赛沃替尼是一种强效、高选择性的口服MET酪氨酸激酶抑制剂。c-MET通路异常激活主要与肿瘤患者治疗过程中使用的治疗方法例如放疗、化疗以及EGFR抑制剂、VEGFR抑制剂等耐药性有关,主要包括MET外显子14跳跃突变、MET基因扩增和c-MET蛋白过表达3种类型。
MET靶点是一个泛靶点,大多数的肿瘤类型中都可能会出现MET基因突变,例如消化道癌、肺癌、肝癌、脑癌等。MET的异常活化虽然在单一瘤种中发生率较低,但由于其跨瘤种的特点,使得c-MET抑制剂赛沃替尼的目标患者人群进一步扩大。

2021年赛沃替尼获在中国获批于单药治疗MET外显子14跳变基因变异晚期非小细胞肺癌(NSCLC)患者并上市,预计于2022年ELCC上公布最终OS分析。
目前全球上市的MET抑制剂除赛沃替尼之外,另有诺华的卡马替尼和默克的特泊替尼分别于2020年先后在美国和日本获批上市,其中特泊替尼也于2021年2月获FDA批准在美国上市。特泊替尼和卡马替尼目前均在中国进行临床II期研究,其他正在全球及中国开发的MET抑制剂目前尚处于临床早期阶段,赛沃替尼在中国市场的进度远快于竞争对手。
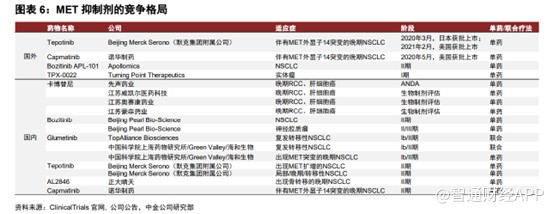
如前文所述,MET是一种泛靶点,可使用的适应症极大,除了已获批的MET外显子14跳变NSCLC适应症以外,和黄医药的赛沃替尼联合奥西替尼治疗第三代EGFRTKI抑制剂耐药的NSCLC、MET驱动的治疗乳头状肾细胞癌(PRCC)和MET驱动的胃癌研究,基于上述这四个适应症对赛沃替尼进行销售额预测,中金公司预计赛沃替尼风险调整后的全球总销售额有望在2035年达到19.49亿美元,和黄医药从中获益金额将于2035年达到6.17亿美元。
在商业化方面,和黄医药选择与在肺癌领域有丰富的产品布局的阿斯利康合作,如奥西替尼、英飞凡等,因此其在肺癌产品的市场推广方面颇具经验,阿斯利康的肺癌商业化团队超过2000人。和黄医药负责赛沃替尼在中国的临床开发、上市许可、生产和供应,阿斯利康负责产品商业化。根据公司公告,阿斯利康根据赛沃替尼在中国的全部销售额向和黄医药支付30%的固定特许权使用费,在中国以外地区支付9%-18%的固定特许权使用费,若未来赛沃替尼PRCC适应症开发成功,阿斯利康支付给和黄医药中国以外地区的固定特许权使用费将提升至14%-18%。不难看出,赛沃替尼市场潜力极大,但受限于商业化能力,辛苦搞研发的和黄医药赚的还是小头,大头给阿斯利康,因此最终能到分到其手里的金额有限。
再看其另外一款重磅产品—索凡替尼,2021年在中国上市,用于治疗晚期神经内分泌瘤患者。
神经内分泌肿瘤起源于遍布全身的弥漫性神经内分泌细胞,主要分布在胃肠道、胰腺中的胰岛和支气管肺系统。根据病灶来源将神经内分泌瘤分类,其中胰腺NET占比约6%,胃肠NET占比约47%,肺部NET占比约27%,其他部位占比约20%。生长抑素类似物常用作G1/2期患者的一线治疗药物,疾病进一步进展后的治疗选择包括以舒尼替尼和依维莫司为代表的抗血管生成的靶向药物和传统的化疗药物。依维莫司仅获批用于治疗G1/2晚期非功能性神经内分泌瘤,舒尼替尼仅获批用于治疗G1/2晚期胰腺神经内分泌肿瘤。索凡替尼可治疗不分病灶来源的所有G1/2级晚期神经内分瘤患者,是在肺部及其他部位也可使用的靶向药物。
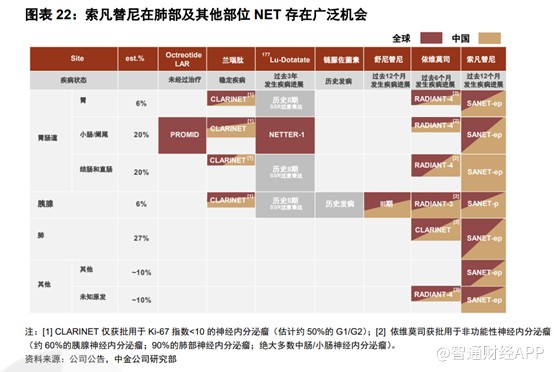
显然索凡替尼也像赛沃替尼一样是“万金油”,可广泛使用,并且和黄医药拥有全球权益,扩展至多个适应症后,亦将获得不菲的收益。但是,目前在中国市场上市后不久,索凡替尼便降价52%进医保,以求放量。数据显示,第六轮国家医保谈判中,目录外67种药品平均降价61.71%,高于2018年的肿瘤药专项谈判 (56.7%)、2019年国谈(60.7%)、2020年国谈(53.8%)。从历年来的医保谈判价格降幅来看,后续医保谈判继续降价的概率不小。
另外,由于索凡替尼在中国治疗胰腺和非胰腺神经内分泌瘤患者的两项取得积极结果,公司欣然向美国FDA递交新药上市申请,然而由于中国III期研究以及一项美国桥接研究的数据包尚不足以支持药品在美国获批。在美国上市申请遭拒后,和黄医药亦撤回了向欧盟EMA提交索凡替尼上市申请。
如此来看,在国内将面临医保持续降价的风险,而国外上市又遇挫,被给予重大希望的索凡替尼亦不过如此。
最后是公司的呋喹替尼,该药已获批于治疗转移性结直肠癌患者,公司亦计划向美国FDA、欧盟EMA及日本PMDA递交上市申请许可。
结直肠癌是全球第三大最常见的癌症死亡原因,Leah H. Biller 等人在美国医学会杂志发表的论 文称全球每年有 185 万人被诊断为结直肠癌,其中20%的患者被诊断为转移性结直肠癌患者。转移性结直肠癌患者通常根据 KRAS 突变状态采用不同的治疗方式。呋喹替尼的获批治疗适应症是转移性结直肠癌的三线或后线系统治疗,目前获得FDA批准用于不可切除转移性结直肠癌患者的三线(四线)疗法药物还有FDA于2012年批准的瑞戈非尼和2017年批准的TAS-102。
虽然结直肠癌是常见癌种,但是市场竞争也十分激烈,药智数据显示,针对结直肠癌这一适应症,中国临床试验有655条,可想而知其市场竞争程度。
不仅如此,和黄医药的呋喹替尼还是针对三线或后线系统治疗,大大压缩了市场空间。
除了结直肠癌以外,和黄医药的呋喹替尼还开展了乳癌、三阴性乳癌、实体瘤、胃癌、NSCLC等适应症,虽然适应症众多,但多为热门适应症,市场竞争均十分激烈。
综上来看,表面来看,和黄医药已有三款商业化产品,并且每个产品的适应症均极广,潜力巨大,但在适应症方面多有重叠,并且不少适应症市场竞争十分激烈,外加上公司在海外临床数据不足,出海受挫,要出海还必须继续“烧钱”,即在海外开展多中心临床研究。而多年入不敷也让公司的现金流压力逐渐增加,若目前已上市的几款产品不能很好的为公司贡献现金流,那么按上半年这样烧钱的速度,现有的现金流亦只能支撑公司两年半的时间。可以说留给和黄医药的时间不多了。
