在集采常态化的背景下,中国医药产业发展速度和格局正在发生深刻的变化,国际化创新俨然已成为当下医药企业的发展共识。2022年是一个充满挑战的年份,基石药业(02616)顶住大环境的“逆风”,收入呈现近乎翻倍式增长,由2021年的2.44亿元大幅攀升至不少于4.75亿元;收入的大幅提升,也使其“造血”能力大幅提升,截至2022年12月31日,公司现金、现金等价物预计超过13亿元。
2022年是基石药业商业化小试牛刀的一年,随着商业化团队的完善和商业化策略的深化,2023年有望成为公司商业化腾飞的关键一年。目前公司的估值仍处于历史底部阶段,且日前刚被纳入沪港通下的港股通标的。作为港股创新药中被低估的标的,基石药业的价值也将进一步被市场挖掘。
蓄势待发,商业化大年已至
作为一家生物制药公司,基石药业专注于肿瘤免疫治疗及精准治疗领域,已建立了一条由15种肿瘤候选药物组成的丰富产品管线。目前,基石药业已获得四款创新药的十项新药上市申请的获批,成功上市的四款药物中,三款为同类首创的精准治疗药物,包括普吉华®(普拉替尼胶囊)、泰吉华®(阿伐替尼片)、拓舒沃®(艾伏尼布片),以及潜在同类最优的肿瘤免疫治疗药物择捷美®(舒格利单抗注射液)。另有多款后期候选药物正处于关键性临床试验或注册阶段。
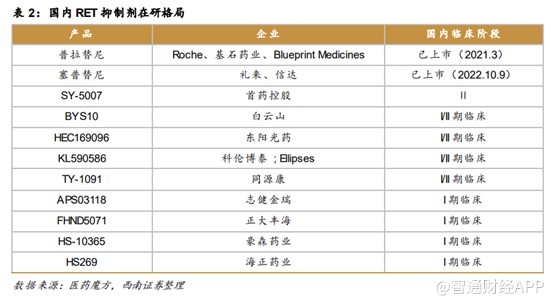
普吉华®(普拉替尼胶囊)是一种口服、每日一次、强效高选择性RET抑制剂,目前已获批两个适应症,一线RET阳性非小细胞肺癌适应症已经递交上市申请,有望于2023 年上半年获批上市。这一适应症将是普拉替尼的关键适应症,获批后有望大幅提升普拉替尼的销售额。
据智通财经APP了解,RET属于原癌基因,其编码的RET蛋白是一种跨膜蛋白,该蛋白属于受体酪氨酸激酶家族。RET融合突变与多种癌症的发生发展相关,最常见的肿瘤谱为非小细胞肺癌(2%)和甲状腺癌(10%-20%)。我国是非小细胞肺癌患者大国,根据《2022年CSCO非小细胞肺癌诊疗指南》,非小细胞肺癌新发人数约70万人,即使仅2%的发病率,每年新发RET阳性NSCLC患者约1.5万人。我国甲状腺癌新发人数约20万人,以15%的发病率计算,RET融合突变甲状腺癌新发人数约3万人,合计5万人。
目前,国内仅两款RET抑制剂获批上市,分别为基石药业的普拉替尼和礼来的塞普替尼,其中,普拉替尼于2021年3月获批上市,比塞普替尼上市时间快1年半,其他在研的产品仍处于临床II期阶段,基石药业的普吉华®先发优势明显,充分享受国内市场红利。
拓舒沃®是基石药业继泰吉华®和普吉华®上市以来的第三款精准治疗药物。2022年1月,拓舒沃®获NMPA批准上市,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病(R/R AML)患者。除了二线适应症外,艾伏尼布联合阿扎胞苷一线治疗AML的适应症目前处于临床Ⅲ期。
作为全球同类首创的强效、高选择性口服IDH1抑制剂,拓舒沃®以其明确的临床优势,获得国内外权威指南一致推荐,成为IDH1突变AML(急性髓系白血病)治疗的首选方案,包括《CACA血液肿瘤指南》2022版、《CSCO恶性血液病诊疗指南》2022版、《中国复发难治性急性髓系白血病诊疗指南》2021版以及《NCCN急性髓系白血病指南》2022版。
资料显示,急性髓系白血病是一种进展迅速的血液和骨髓癌症,是成人急性白血病中最常见的类型。美国每年约有2万例新发病例,欧洲每年约有4.3万例新发病例。在中国,每年约有7.53万白血病新发病例,其中急性髓系白血病患者的占比约为59%。发病率随着年龄的增长显著增加,中位诊断年龄为68岁。大多数AML患者对化疗无应答并进展为复发或难治性急性髓系白血病,患者五年生存率约29.5%。6%-10%的AML患者携带IDH1突变,突变的IDH1酶阻断了正常的造血干细胞分化,促进了急性白血病的发病。
拓舒沃®的上市,填补了IDH1突变AML领域精准治疗的空白,对于携带IDH1突变的急性髓系白血病的精准诊疗,具有里程碑意义。AML中IDH靶点的发现, 拓宽了对白血病发病机制的认知边界,拓舒沃®的成功研发,加深了对于AML针对特定突变靶点精准诊疗思路的深刻理解。随着拓舒沃®的上市,将给IDH1突变患者的治疗带来更优的选择, 同时基石药业也在积极拓展拓舒沃®的其他适应症,包括在新诊断的IDH1突变AML成人患者的一线疗法,以及用于IDH1突变经治的局部晚期或转移性胆管癌患者等。
目前,全球仅两款IDH1抑制剂获批上市,分别为拓舒沃®和olutasidenib,但olutasidenib在我国未申报临床。除了拓舒沃®外,和黄医药、华润三九、正大天晴也布局了IDH1抑制剂,但均处于临床I期。作为国内首家上市IDH1抑制剂,拓舒沃®将全面享受整个市场的红利,在公司深度的商业化下,为公司创造更加丰厚的回报。
提起PD-(L)1,大部分人的刻板印象便是“卷”,实际上这是一种非常偏见的看法。虽然PD-(L)1生产企业众多,但关键还是看相同适应症的产品有多少。
基石药业旗下的择捷美(舒格利单抗注射液)是首款可用于Ⅲ期非小细胞肺癌的国产PD-L1。资料显示,舒格利单抗是一款全人源全长抗天然G型免疫球蛋白4(IgG4)单抗药物,鉴于此,舒格利单抗在患者体内产生免疫原性及相关毒性的风险更低,与同类药物相比具有独特优势。舒格利单抗也因此获得中美双BTD(突破性认定)。
Ⅲ期非小细胞肺癌是肺癌的诊治中最为困难和最具挑战性的,在过去30年,尽管Ⅳ期非小细胞肺癌取得了长足进展,如近年来一批TKI、PD-1单抗等相继获批NSCLC适应症,但这些适应症大多为Ⅳ期NSCLC,并非Ⅲ期NSCLC。 Ⅲ期不可切除的NSCLC的治疗进展极其缓慢,标准治疗仅推荐同步放化疗,但标准治疗中位生存期仅20.3-28.7 个月。
从发病人数的角度,根据《非小细胞肺癌诊疗指南(2021 版)》,16%患者诊断时为Ⅰ/Ⅱ期,22%为Ⅲ期,57%为Ⅳ期。Ⅲ期肺癌分为可手术切除和不可手术切除两类,其中不可手术切除的患者约占Ⅲ期肺癌患者人群总数的30%。目前,针对不可手术切除的Ⅲ期肺癌患者,除了化疗方案外,免疫疗法仅度伐利尤单抗和舒格利单抗。
度伐利尤单抗仅可用于同步放疗后的巩固治疗,但70%的患者无法耐受同步放化疗,舒格利单抗优效克服了这一瓶颈。基石药业的舒格利单抗是首个可用于同步或序贯放疗后无疾病进展的不可切除Ⅲ期NSCLC的一线疗法,具有里程碑意义。
基于舒格利单抗突出的特性,基石药业也开发了舒格利单抗其他的适应症,目前国内已获批两项适应症,ENKTL适应症已递交上市申请并被纳入优先审评,目前正在审评中,一线治疗胃癌适应症的上市申请也已于近日递交,一线治疗食管鳞癌适应症计划于2023年上半年提交上市申请。不仅如此,舒格利单抗一线四期NSCLC适应症的上市申请也先后在英国和欧盟获得受理。可见,基石药业的PD-L1极具市场潜力,被严重低估。
伴随着后续上述产品的获批上市,今年将是基石药业商业化腾飞的一年。
蕴含百亿美元大品种,PD-1+ADC黄金时代已至
一直以来,市场对于默沙东持续投资加注科伦博泰ADC拥有较大的疑问与分歧,直到近期科伦药业在交流纪要中指出“默沙东看重科伦博泰ADC,在很大程度上也是看重与K药联合的潜力,从而进一步可延长K药的生命周期,继续保持K药的地位。”
全球制药巨头默沙东、阿斯利康合作探索“PD-1+ADC”治疗方案上获得了较积极的进展,双方已经启动了DS-1062(Trop2 ADC)与K药(PD-1)联用一线治疗PD-L1阳性晚期/转移性NSCLC的三期临床,以取代现有化疗的标准疗法。
该组合三期临床的开展得益于Ib期的优异数据:缓解率(ORR)为37%,叠加铂类化疗治疗ORR为41%;尤其在作为一线疗法时效果更好,疾病控制率(DCR)为100%。
另外,默沙东在三阴乳腺癌领域选择与吉利德开展合作,通过K药和Trodelvy组合临床探索,来冲击三阴乳腺癌一线治疗(Trodelvy已获批二线疗法)。
至此不难看出,“PD-1+ADC”的市场潜力。目前国内药企纷纷布局PD-1以及ADC靶点,除了拥有极具市场潜力的舒格利单抗外,基石药业旗下的CS5001是全球研发进展最快的靶向受体酪氨酸激酶样孤儿受体1(ROR1)的ADC之一,具有全球同类药物最佳潜力。
据智通财经APP了解,ROR1是一种典型的肿瘤胚胎蛋白,在成体组织中低表达或者不表达,而在多种肿瘤中都有高表达,是一种极具潜力的ADC靶点。临床前研究数据表明,CS5001在多种表达ROR1肿瘤细胞系展现出了较强的选择性细胞毒性,并在血液和实体肿瘤异种移植小鼠模型中均显示出显着的体内抗肿瘤活性。
基于早期研究的积极数据,ROR1有望成为具有广谱抗癌潜力的新药靶点,用于非小细胞肺癌、三阴乳腺癌、卵巢癌、白血病、非霍奇金淋巴瘤等。据了解,这些病例在全球每年发病超过300万例。ROR1一旦成药,全球空间有望超百亿美元。
目前,全球仅三款ROR1 ADC处于临床阶段,分别是zilovertamab vedotin、NBE-002、ABL202。
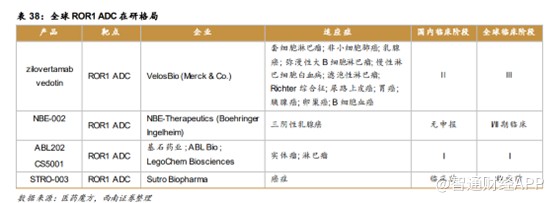
基于早期研究的积极数据,ROR1 ADC相关交易均获得了极高的交易对价,展现出MNC对这一靶点的高度看好。2020年11月5日,默沙东宣布以27.5亿美元收购了VelosBio,将其主打产品VLS-101收入旗下。2020年12月,勃林格殷格翰宣布以14.3亿美元收购瑞士创新药研发公司NBE-Therapeutics,此次收购的核心在于靶向ROR1 ADC药物NBE-002。一旦CS5001披露Ⅰ期数据,有望吸引MNC企业,以不错的金额授权出海。
从投资科伦博泰ADC再到高价收购VelosBio,默沙东意欲通过联用巩固K药的地位,国内同时拥有PD-1以及ADC药物的Biotech必然也可以通过这一路径“大赚一笔”。
而基石药业同时拥有极具市场潜力的PD-1以及ADC药物,除了单药以外,后续可拓展联用价值。
除了ROR1这一大热门药物外,基石药业还有10余个正在进行的早期研发阶段项目,包括多特异性、抗体偶联药物、抗体-细胞因子融合分子,以及用于靶向其他不可成药细胞内蛋白的专有平台,并且多款具有同类首创、同类最优潜力的新药,可以说基石药业的研发水平已经挤进一线创新药行列。
战略合作多点开花,沪深两市港股通“双纳入”价值有望被挖掘
管线的最终兑现,仍看商业化能力。公司商业销售团队覆盖超过700家医院,所覆盖的医院占精准治疗药物相关市场的约70%-80%。三款精准治疗药物已被纳入超过17项国家指南,并且被超过120项商业保险纳入其中。除了扩建自己的销售团队外,基石药业与国药控股进行战略合作,扩大普吉华®(普拉替尼)及泰吉华®(阿伐替尼)于医院及药店的分销范围。
在商业合作方面,基石药业也是收获颇丰。
2021年基石药业与辉瑞就洛拉替尼在大中华区联合开用于二线治疗ROS1阳性非小细胞肺癌(NSCLC)的合作。2022年5月,在基石药业与辉瑞的共同努力下,洛拉替尼治疗ROS1阳性晚期NSCLC的联合开发项目实现首例患者入组。
在与EQRx的合作方面,公司于美国、英国及欧盟等全球多个国家及司法管辖区就舒格利单抗治疗NSCLC及ENKTL适应症的注册进行监管申请。公司还与EQRx合作探究在全球市场进一步扩大该药物适应症的可行性 (包括胃癌及食管癌)。同时,公司正与EQRx协力合作,在美国及主要欧盟市场开展nofazinlimab治疗HCC的全球III期研究。
此外,公司与恒瑞的合作也在进一步加深,2021年,基石药业与恒瑞建立战略合作关系,通过利用各自研发及商业专长,加速开发及商业化抗CTLA-4单克隆抗体(CS1002)以充分释放其商业价值。2022年上半年,恒瑞获得国家药监局关于CS1002联合治疗晚期实体瘤的Ib/II期试验的IND批准。
在多方位的努力下,2023年的基石药业可谓是蓄势待发。值得欣喜的是,近日,沪深交易所互联互通股票标的范围扩大规则正式对外发布,内地与香港资本市场迎来全面双向扩容,,资本市场的双向开放程度再次提高。本次调整中,基石药业获首批新增调入沪港通下港股通股票,并自2023年3月13日起生效。
此次是沪深港通股票标的范围扩容后的首次调整。基石药业已于2021年9月6日获纳入深港通股票名单,本次调整后,公司将成为A股沪深两市港股通“双纳入”股票。这意味着,基石药业将进入更多投资机构的视野,吸引投资者的关注和参与。现如今,基石药业正处于价值洼地,伴随着公司管线的更多进展以及业绩的释放,其洼地也将快速被市场填平。
