在沉寂4个多月后,百心安股价突然有了“心跳”。
智通财经APP观察到,4月12日,百心安-B(02185)早盘飙升,股价最大涨幅达到75.42%,早盘成交量便超过300万股,成交额超过2000万港元,创下今年以来的新高。
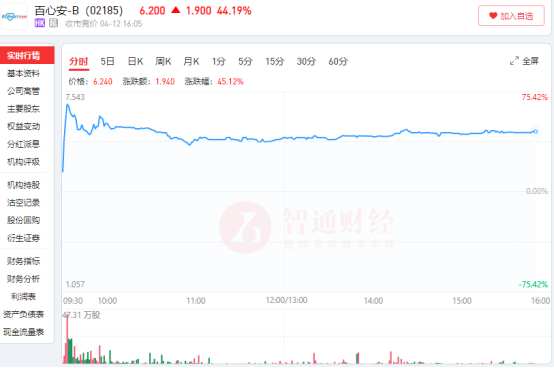
之所以市场如此兴奋,只因为百心安在昨天发布一则公告,披露其用于原发性高血压患者的第二代Iberis多电极肾动脉射频消融导管系统的随机对照临床试验(Iberis-HTN)已达到其主要临床终点。关键临床里程碑的到达预示着这款产品临最终的商业化越来越近。
实际上,目前在全球范围内,仅有五家公司的RDN产品获得FDA“突破性设备”认定,而其中研发Symplicity
Spyral的美敦力才在去年11月8日,向FDA递交了产品上市前批准(Premarket
Application,PMA),并提交了最新临床试验结果供FDA审查和批准。
此前市场预计美国与中国RDN市场或将在2023年同时起步。此次百心安RDN产品临床取得阶段性成果显然对市场有一定激励作用。
肾神经阻断——高门槛的疗法
高血压是人类最为普遍的基础疾病之一,也是单一最大的致死因素。在我国由于近年人口老龄化、居民生活方式改变等原因,高血压患病率呈上涨趋势。2021年,我国高血压患病人数已约3.4亿人,位居全球首位。
对于高血压治疗,药物治疗是当前最主要的治疗手段,但整体控制率不高,只有23%,且存在依从性差、药物副作用大等问题,RDN技术的出现则有望解决药物治疗局限性。
从作用机理来看,肾交感神经的兴奋性增高是引起高血压的重要神经机制,RDN通过微创介入手段利用能量阻断大脑与交感神经之间的信号传导,降低交感神经兴奋性,从而实现降压目的。
RDN的作用机理看似简单,但从产品研发到临床试验,每个步骤都存在门槛。最典型的莫过于美敦力的RDN研发。
据智通财经APP了解,2010年11月美敦力以8亿美元现金收购了RDN先驱Ardian。完成收购后,美敦力开始了Symplicity的研究。两个早期的大型研究HTN-1和HTN-2均为单臂研究,研究验证了RDN的降压效果。
但随后美敦力进行的HTN-3是一项美国大型的随机假对照研究,并由于研究团队临床终点制定失误,导致RDN组和假手术组的血压下降无显著差异,使得该试验最终被认定失败。
在研究HTN-3并分析结果之后,美敦力重新启动了临床试验项目,继续进行了一系列的临床试验。最终在2022年美国经导管心血管治疗学术会议上,美敦力发布了HTN-3的3年研究结果,显示RDN组相对于假手术组血压明显降低,并在11月向FDA提交了PMA。
美敦力在RDN领域的研发一波三折也从侧面反映出该领域研发的高门槛。其实不仅仅是美敦力,全球有众多医械企业在RDN领域进行研发投入,截至2020年,全球RDN技术累计研发资金超过50亿美元。

广阔市场带来的商业化机会
但即便如此,RDN依旧是包括美敦力在内众多医械企业专注研发的领域,关键在于其广阔的潜在市场。
高血压是一个全球性的大问题,全球超过 10
亿人患有高血压,根据美敦力2021年10月公司公告,全球RDN市场规模将达到数十亿美元,美敦力2026财年RDN全球市场收入将超过5亿美元,2030财年将达20-30亿美元。2026-2030年CAGR为41.4%-56.5%。
其中,中国是最大的高血压患病市场。根据弗若斯特沙利文,由于人口老龄化及生活方式不健康等因素,高血压患病率呈上升趋势,其预计中国高血压的患者总人数从2019年的3.17亿增长至2030年的3.88亿,CAGR为1.8%;2021年,中国顽固性高血压患者数达4970万,比例为15.0%。

另一方面,据市场测算,2021年,美国与中国成人高血压控制率分别为42.7%和23.0%。患者高发率以及低控制率让中国市场对高血压治疗更优方案的需求更加迫切,而这也为百心安的在研产品提供了一个潜在大市场。
值得一提的是,百心安的产品相较全球其他的竞品也存在竞争优势。
目前全球业界在RDN领域探索多种消融方式,其中射频及超声消融占据主导地位。截至2022年3月,FDA认定的RDN突破性器械均为射频或超声消融;部分厂家亦在尝试冷冻消融及酒精消融。但从入路看,百心安Iberis是全球唯一允许经股动脉和经桡动脉入路的RDN产品。

此外,百心安Iberis可将射频能量传递到肾动脉血管壁,对肾动脉周围分布的交感神经进行热消融,从而降低交感神经活性和神经信号,从而起到降低血压的效果。
此次,百心安宣布第二代Iberis多电极肾动脉射频消融导管系统的随机对照临床试验(Iberis-HTN)已达到其主要临床终点。该试验旨在评估本公司的第二代Iberis®多电极肾动脉射频消融导管系统治疗原发性高血压的安全性和有效性。共有217名受试者入组该试验。

试验结果表明,试验组于术后6个月24小时动态血压期间平均收缩压较基线变化的主要临床终点达到疗效的主要临床终点,明显优于假手术组,并且在安全性方面与接受假手术的患者相似,没有增加不良事件的风险,且亦无与试验器械相关的严重不良事件。
并且公司表示,将继续推进相关工作,以尽快取得临床研究报告用作提交产品注册申请。而这便意味着百心安第二代Iberis产品即将迎来商业化。根据此前公司年报预测,该产品或在2024年第二季度至第三季度正式商业化,从时间来看或将先于其BRS产品成为百心安首款商业化产品。
从目前国内的市场竞争情况来看,截至2022年,已有7家公司的RDN产品进入NMPA创新器械特别审批绿色通道,按时间次序分别为信迈医疗、百心安、心诺普医疗、美敦力、微创电生理、康沣生物、魅丽纬叶。可见百心安处在国内RDN行业第一梯队,若能在近年率先实现商业化铺开销售,将有望为其带来可观的销售收入。
实际上,百心安上市一年以来,其一直较为股价坚挺,但由于此前外部药械板块环境转差加之内部一直没有商业化产品提供造血能力,使得公司股票实际缺乏流动性,以至于去年11月开始在几千万元的卖单下就开始股价雪崩,目前公司市值只剩下峰值的十分之一。但这也让百心安客观上处在估值底部,而其估值重塑将有望随着首款产品商业化到来。
