去年10月,港股生物医药板块的一股热潮吹至兆科眼科-B(06622),其公司股价随波上涨。今年2月3日,兆科眼科股价来到6.74港元,创下自2022年以来的股价新高。
但接下来随着这股热潮的褪去,兆科眼科股价再次失去支撑,开始了连续4个月的下跌。6月1日,兆科眼科股价跌至2.40港元,4个月内股价累计跌幅达到64.39%。
虽然股价重返去年10月低谷,但这次兆科眼科并未“消沉”太久,仅4个交易日后,兆科眼科便仅凭一则公告单日股价最高涨幅突破27%。
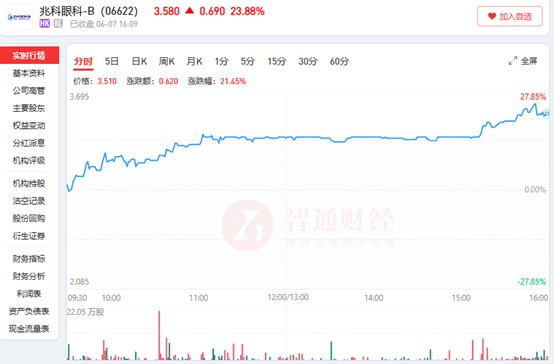
这则公告便是:“美国食品药品监督管理局(FDA)已接纳审理Vyluma的主要复方NVK002(低剂量阿托品0.01%)作为儿童近视的潜在疗法的新药申请。”
儿童眼科神药上市意味着什么?
智通财经APP了解到,近视是一种屈光不正的现象,当眼在调节放松状态下,平行光线进入眼内,其聚焦在视网膜之前,导致视网膜上不能形成清晰像。
目前,近视已成为全球关注的公共卫生问题,据统计目前全球近视人数约26亿,预计到2050年,全球近视人群将达49.49亿人,患病率为52%。
近视治疗包括非手术治疗和手术治疗,其中非手术治疗包括框架眼镜及角膜接触镜(软性及硬性角膜接触镜)的佩戴。手术治疗包括角膜激光手术及人工晶体植入术等,但因一定的手术风险性,存在一定的争议,而且手术治疗一般要求在18岁以后,这也就意味着目前3-17岁的儿童和青少年缺乏有效近视治疗手段。
而这也正是阿品托获得广泛关注的主要原因。据悉,阿托品是唯一经循证医学验证能有效延缓近视进展的药物,被称为是近视防控中的“神药”。
此前临床结果显示,阿托品近视控制效果呈现浓度依赖效应,高浓度阿托品滴眼液对近视的控制效果可高达60%-96%,但高浓度阿托品滴眼液存在严重畏光、近视力下降等不良反应以及停药后反弹效应。
近期研究显示,0.01%、0.02%和0.05%低浓度的阿托品滴眼液有防止眼轴变长、控制近视增长的效果。
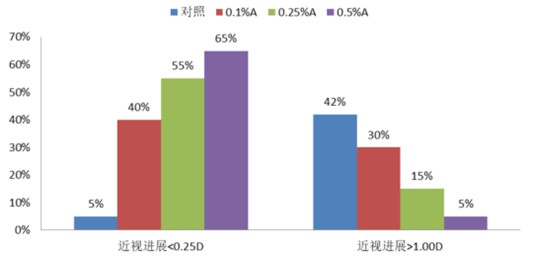
由于低浓度阿品托适用于3-17岁的患者,使其较其他视力矫正途径的商业化市场更广阔。
从国内市场角度来看,2020年中国近视人数为1.01亿人,同比下降1.9%。其中,2020年8-12岁中国近视人数为8050万人,同比增长0.5%;13-15岁近视人数为4795万人,同比下降0.02%;16-18岁近视人数为4839万人,同比下降2.2%。其中,2020年中国8-12岁人口近视率为36.3%;13-15岁人口近视率为69.8%;16-18岁人口近视率为79.1%。
目前,低浓度阿托品(主要以0.01%为主)制剂产品已在新加坡、中国台湾、中国香港和日本等近视发病率的较高地区上市,年平均使用成本约3000-4000元。若国内产品正式上市,按照每年1500元成本(价格低于手术和角膜塑形镜成本的1/5)计算,阿托品制剂理论市场空间高达1200亿元。
从市场竞争角度来看,目前国内还没有经审批正式上市的低浓度阿托品滴眼液,但庞大的近视人群催生了低浓度阿托品的市场需求,一些上市公司也通过院内制剂的方式“曲线上市”低浓度阿托品。
2019年1月28日,兴齐眼药通过旗下的兴齐眼科医院,将低浓度阿托品滴眼液作为该院的院内制剂上市;同年12月,兴齐眼科医院获得互联网医院资质,通过互联网医疗方式实现低浓度阿托品处方的开具以及销售。
但随着国家监管趋严,《药品管理法实施条例(修订草案征求意见稿)》规定,第三方平台提供者不得直接参与药品网络销售活动,阿托品滴眼液受到互联网禁售监管。2022年7月,兴齐眼药宣布其互联网医院暂停处方院内制剂0.01%硫酸阿托品滴眼液,仅可在实体医院购买。
从全球在研产品竞争来看,目前全球还有多款针对近视的低浓度阿托品滴眼液进入3期临床,如Vyluma公司/兆科眼科的NVK002、兴齐眼药的0.01%硫酸阿托品滴眼液、Eyenovia公司/极目生物的AVRN002
(MicroPine)、Sydnexis公司/参天制药的SYD-101、欧康维视的OT-101以及恒瑞医药的HR19034。
其中,Vyluma公司/兆科眼科的NVK002研发进展处在前列,甚至有望成为全球儿童眼科用药的FIC产品。
年亏4亿能否靠“神药”翻盘?
去年10月,兆科眼科发布公告,合作伙伴Vyluma公司宣布NVK002用于儿童近视加深的III期CHAMP研究取得积极结果,且该结果已在加州圣地牙哥的美国视光学会(American
Academy of Optometry)年会上口头汇报。
此次披露的CHAMP研究是一项在美国及欧洲进行的三臂、随机、多中心、双盲及安慰剂对照的III期研究,纳入了接近600例入组时年龄介乎3至17岁的儿童及青少年。研究分为两个阶段:一是评估NVK002安全性及三年治疗期内的疗效,其后入组的患者会重新随机进行为期一年的单盲治疗。
数据分析显示,与安慰剂组相较,使用0.01%阿托品剂量组患者在所有关键结果测量上,包含缓解者分析(responder
analysis)、平均等效球面度数(SER)、在第36个月时与基线相较的平均眼轴长度等,都显示出具统计与临床意义上的差异。
而0.02%阿托品剂量也在许多时间点上展现疗效,包含在第36个月时达成统计上显著的平局眼轴长度变化。不过,其在缓解者分析结果在36个月时未达到统计显著标准。
此外,与安慰剂相较,两个剂量的NVK002都展现良好的安全性与耐受性。试验没有观察到眼睛相关的严重不良反应(SAE)。最常见与眼睛相关的不良反应包含充血、畏光、过敏性结膜炎、眼部瘙痒与刺激。
值得一提的是,除了合作公司Vyluma正在做的临床外,兆科眼科也在中国并行进行两项III期临床试验,即为期2年的第III期临床试验(该项目被称为“中国CHAMP”)及同步进行的为期1年的III期桥接临床试验(该项目被称为“小型CHAMP”)。
据兆科眼科公告,其在中国的CHAMP及小型CHAMP已分别于去年7月21日及7月28日完成患者入组。同时,一旦FDA批准NVK002,该公司计划结合小型CHAMP的结果与第III期CHAMP研究的Vyluma数据,在中国提交新药申请。
也就是说,对于兆科眼科来说,此次FDA接纳审理NVK002是一个关键节点,甚至一定程度能决定该产品在中国新药上市的速度。
对于兆科眼科来说,手握一款千亿市场潜力的大单品,首要任务显然是尽快实现商业化,提高公司的造血能力和估值。
从此前披露的年报数据来看,截止2022年12月31日止年度,兆科眼科录得总亏损约4.07亿元;报告期内,公司的研发费用支出约为人民币2.96亿元。虽然目前兆科眼科公司账上仍有17.25亿元现金,但在当前港股生物医药板块以企业造血能力研判估值的当下,一款能够带来正向现金流的重磅产品对于兆科眼科来说,还是非常必要的。
