近年来宏观层面的不确定因素增多,港股医药板块波动频繁,整体估值快速下滑。造成这一问题的原因在于生物医药公司长周期的研发与较短的融资窗口期存在矛盾。
据智通财经APP了解,在融资环境趋紧的背景下,如果经营、融资状况未有改善,大约30%港股18A公司在2024年面临现金耗尽的境地。也正是因此,“现金红线”成为当下投资18A企业的重要指标。
然而,对于一家18A企业来说,持有资金在“现金红线”之上还远远不够,缺乏“造血预期”也将成为其在二级市场实现估值增长的重要阻力。比如,嘉和生物-B(06998)正面临的有现金没产品的尴尬局面。
产品商业化独木难支
自2018年港股18A“主板上市规则”发布以来,5年间已有60家18A企业登陆港股市场。对于投资者来说,今年是港股18A企业投资的转折点,因为已经有4家企业率先实现盈利。
从盈利的18A企业发展过程不难看出,一家生物医药企业要想盈利,首先需要在针对较大市场空间的领域研发出具有较强市场竞争力的产品,然后通过进一步铺开销售渠道,获得收益并最终覆盖公司的成本支出。
对于嘉和生物来说,目前公司“取得商业化收入”这一步还难以稳健踏出。这与其管线研发进度慢有一定关系。
上市之初,嘉和生物的在研管线十分丰富且颇具竞争力,但两年多过去了,其管线进展十分缓慢,此前的竞争力也丧失殆尽,目前仅有一款英夫利西单抗生物类似药获批,PD-1、CDK4/6抑制剂原计划的获批时间也一再推迟。

今年6月12日,嘉和生物发布公告称,旗下PD-1药物杰诺单抗(GB226)治疗复发/难治性(R/R)外周T细胞淋巴瘤(PTCL)的新药上市申请未获中国国家药监局(NMPA)批准。其也成为首个在国内被拒批的国产PD-1药物。
随着杰诺单抗被拒,嘉和生物就仅剩去年获批的英夫利西单抗一款上市产品。据智通财经APP了解,去年2月28日,NMPA发布批件,嘉和生物英夫利西单抗生物类似药获批上市,成为国产第3款英夫利西单抗生物类似药。
英夫利西单抗是强生/默沙东研发的一款特异性阻断肿瘤坏死因子(TNF-α)的人鼠嵌合型单克隆抗体。该产品在1998年首次获FDA批准在美国上市,次年在欧洲获批上市,2006年在国内获批上市,商品名为类克®。
国内市场方面,从市场规模来看,英夫利西单抗在中国的市场规模在2019年为人民币6亿元,预计到2023年将增长至32亿元,到2030年将达到75亿元。
不足百亿的市场规模与其他热门单抗赛道显然存在较大差距,但这个赛道的国内竞争激烈程度一点也不亚于其他赛道。除了原研药外,国内首款英夫利西单抗生物类似药在去7月获批,来自泰州迈博太科药业。同年9月份,海正生物的英夫利西单抗获批上市,而嘉和生物是随后的第3家。
但就在嘉和生物的英夫利西单抗上市后2个月,迈博太科药业的注射用英夫利西单抗(规格:100mg/瓶,商品名:类停)挂网价从1288元下调至1268元,刷新国内注射用英夫利西单抗的最低价格。
毫无疑问,英夫利西单抗赛道内的竞争对于嘉和生物后续的产品商业化已经“不太友好”,而同为TNF-α药物的阿达木单抗及其生物类似药的市场冲击同样不容忽视。
据不完全统计,目前全球获批上市TNF-α药物40家,其中获批最多的TNF-α药物为阿达木单抗,其次为英夫利昔单抗。以阿达木单抗作为参照,原研药修美乐降价83.02%、以1240元纳入医保后,首款上市的阿达木生物类似药(格乐立)定价为1160元/支,价格为修美乐的90%。随后上市的阿达木单抗生物类似药进一步让利,海正药业的安健宁、信达生物的苏立信均报出1150元/支的售价,而略微落后的汉达远售价则已低至899元。
而据去年5月云南省政府采购和出让中心发布的《关于国家医保谈判药品同通用名药品挂网交易的公示(二十)》公示信息,嘉和生物的注射用英夫利西单抗定价1280元/瓶,其面临的市场竞争压力程度可见一斑。
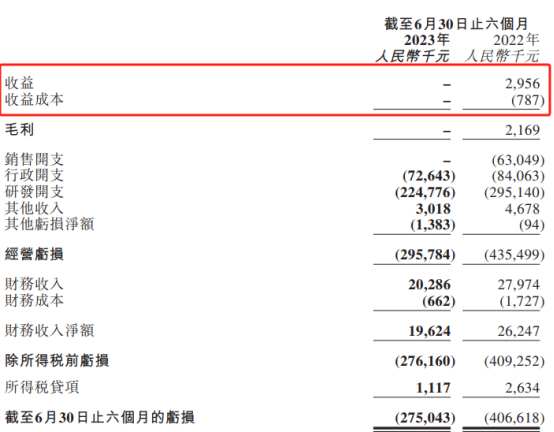
据嘉和生物发布的中报,截至今年6月30日,佳佑健®(GB242,英夫利西单抗)已经完成全国26个省市的挂网采购,其中报告期内增加9个省市。然而,根据嘉和生物2022年财报显示,佳佑健全年销售额1190万元,但在今年上半年嘉和生物的收益却变成了零。
“造血难”或成老大难
在财报中,嘉和生物提到:“截至2023年6月底,结余13.6亿人民币现金,足够支持公司未来3-4年的稳定运营。”
然而,首款产品佳佑健不能为公司稳定且规模化的造血,公司的造血预期压力便给到了后来的管线产品,但今年上半年PD-1产品申请遭拒让公司的商业化之路变得更加崎岖。
今年6月12日,嘉和生物发布公告,旗下PD-1药物杰诺单抗(GB226)治疗复发/难治性(R/R)外周T细胞淋巴瘤(PTCL)的新药上市申请未获中国国家药监局(NMPA)批准。而这是首个在国内被拒批的国产PD-1药物。
实际上,嘉和生物2017年就启动了杰诺单抗的I期临床试验,2020年向NMPA递交了杰诺单抗治疗R/R
PTCL的上市申请,同年7月获受理并被纳入拟优先审评;然而,该申请历时近三年最终遭拒。
虽然嘉和生物未披露杰诺单抗审批不通过的具体原因,仅在公告中表示,预计其他临床试验或公司其他候选药物的开发进展不会受到其影响,但该产品的上市申请主要基于其单臂II期临床试验Gxplore-002。在这个临床试验中,主要研究未设置对照组且研究结果也只公布了36.3%的客观缓解率(ORR),并没有体现患者的生存获益。以上研究数据或许是造成杰诺单抗被拒的原因之一。毕竟全球还没有PD-1药物获批用于PTCL治疗的先例,药审中心保持谨慎态度是能够预期的。
从中报披露的研发进程不难看到,目前嘉和生物仅有盐酸来罗西利片(GB491,Lerociclib)来到新药上市许可申请阶段,并已经获得中国国家药品监督管理局(NMPA)正式受理。
目前来看,GB491是一款新型、有效、选择性及口服可生物利用的CDK4/6抑制剂,由嘉和生物与美国G1
Therapeutics公司联合研发,用于结合内分泌治疗/靶向疗法治疗乳腺癌。
根据2020年欧洲肿瘤学术大会(ESMO)上发表的资料,GB491相比现有中国市场上已经获批上市的CDK4/6抑制剂哌柏西利显示出更好的安全性,有望成为同类最佳CDK4/6候选药物。
但CDK4/6
抑制剂在国内的竞争之势早就是一片红海,获批产品不仅有哌柏西利、阿贝西利、利柏西利这三款进口产品,还有国产产品恒瑞的达尔西利上市。并且,辉瑞的哌柏西利专利已于2023年1月到期,仿制药产品已获批上市。除此以外,据不完全统计,围绕CDK4/6的研究已有超过20个项目处在临床阶段。
也就是说,即便GB491能在年内上市,也未必能为嘉和生物带去良好的市场变现预期。
所以,今年上半年嘉和生物完全砍掉了销售开支、行政开支同比减少了13.58%,甚至研发费用也同比减少了23.84%,这才使得公司今年的净亏损同比收窄了32.36%,也让公司在现有资金下运营时长延长至3-4年。对于现在的嘉和生物来说,节流“过冬”策略自然合理,但何时开源却更是关键。
