11月6日,中国国家药监局药品审评中心(CDE)官网公示,第一三共(Daiichi
Sankyo)申请的注射用德曲妥珠单抗新适应症拟纳入优先审评,单药适用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。公开资料显示,德曲妥珠单抗(Enhertu)是阿斯利康(AstraZeneca)(AZN.US)和第一三共联合开发的一款靶向HER2的抗体偶联药物(ADC),此前已在中国获批治疗HER2阳性和HER2低表达成人乳腺癌患者。
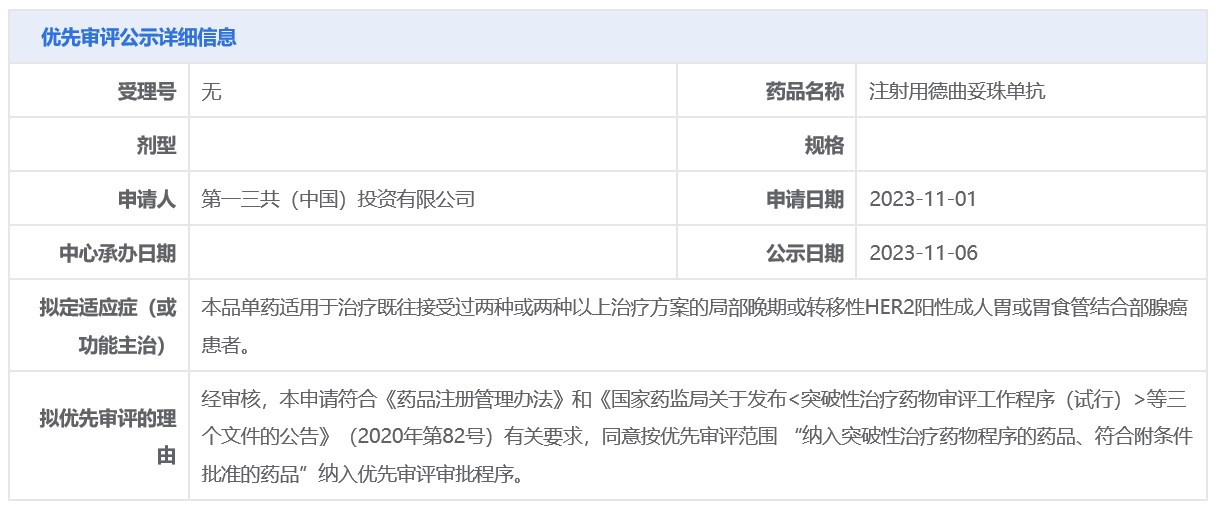
2023年2月,德曲妥珠单抗在中国获批治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者;同年7月,该产品新适应症再获批准,单药适用于既往在转移性疾病阶段接受过至少一种系统治疗的或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2低表达成人乳腺癌患者。根据CDE公示,此次德曲妥珠单抗拟纳入优先审评,针对适应症为HER2阳性成人胃或胃食管结合部腺癌。
