在核心产品奥布替尼成功商业化后,诺诚健华(HK:09969)再次迎来里程碑。9月9日,诺诚健华正式在科创板启动招股,融资金额接近30亿元。二次上市成功后,诺诚健华成为又一家“A+H”两地上市的药企。
诺诚健华的二次上市之旅,市场中频传对其这次融资的质疑之声。质疑者认为,截止2021年底,诺诚健华资产负债表中仍坐拥59.7亿元货币资金,公司并不存在“资金忧虑”,拥有如此雄厚的资金优势,诺诚健华却依然选择二次上市进行融资,似乎并不符合情理。
这种基于资金状况的推论似乎有几分道理,毕竟借助上市套现的案例不胜枚举。但这样的质疑背后,实则也很大程度上反映出市场对当前中国创新药窘境的忽视:
虽然二次上市让诺诚健华的现金储备进一步增加,但却难以判定其商业化道路就会一帆风顺,对这家公司个体而言,59.7亿元的资金可能并不能衣食无忧;而对整个中国创新药企集群而言,发展中的困境远超大多数投资者的想象。
第一座山:后发劣势
作为诺诚健华唯一商业化的产品,奥布替尼承载了公司全部的希望,但其想要正常成为一款王牌产品,依然任重而道远。
在奥布替尼上市之前,全球市场中已经存在4款同类产品:强生的伊布替尼(2013年11月上市)、阿斯康利的阿卡替尼(2017年10月上市)、小野制药的替拉鲁替尼(2020年3月上市)、百济神州的泽布替尼(2020年6月上市),与竞争对手相比奥布替尼并没有先发优势。
但由于奥布替尼仅在国内获批,因此其主要面临来自强生的伊布替尼和百济神州泽布替尼的竞争,竞争压力并没有那么大。
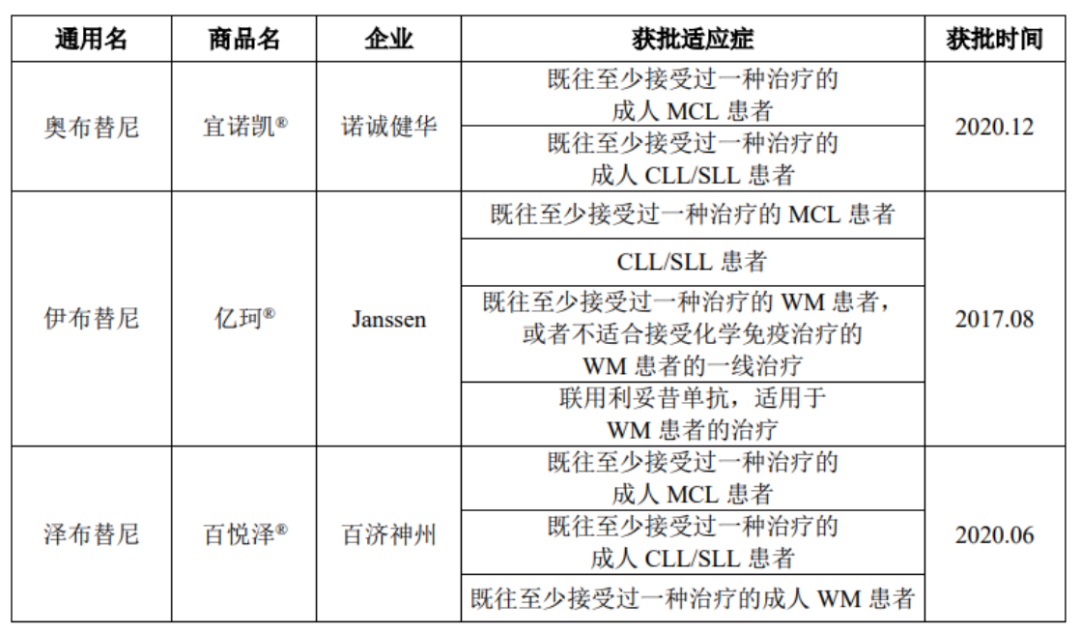
图:中国获批上市的BTK抑制剂,来源:招股书
奥布替尼想要颠覆国内BTK抑制剂的市场格局,就必须击败行业龙头伊布替尼,正所谓知己知彼百战百胜,因此搞清楚伊布替尼的成功之路对于诺诚健华来说十分重要。
纵观伊布替尼的发展史,自2014年上市以来,伊布替尼销售额每年都出现高速增长,其更是在2021年创下97.8亿美元的销售纪录,这可以看做是BTK抑制剂的天花板。细致分析不难发现,伊布替尼销售额持续攀升背后,实则存在两大推动因素:先发优势、适用症扩增。
在2017年阿斯利康的阿卡替尼上市之前,伊布替尼享受了长达4年的独占期,在这个过程中,它将适用症由最早获批的套细胞淋巴癌(MC)扩增至慢性淋巴细胞白血病(CLL)和小细胞淋巴瘤(SLL)、华氏巨球蛋白血症(WM)等多种疾病。简而言之,在竞争对手出现前,伊布替尼已经建立起强大的产品护城河,直接成为BTK抑制剂的金标准。
虽然后续推出的BTK抑制剂都宣称比伊布替尼更优秀,但截止目前依然没有产品在“头对头试验”中胜出,因此也始终没有其他产品能夺取伊布替尼CLL和SLL一线疗法的地位。
例如早在2015年,阿卡替尼就开展了与伊布替尼针对高风险CLL的“头对头试验”,最终结果显示,两款药物的中位无进展生存期(mPFS)均为38.4个月,没有显示出统计学差异。泽布替尼也在2017年开展了关于WM的“头对头试验”,其结果同样也没有达到主要终点。
在这里我们有必要展开聊一下“头对头试验”。“头对头试验”指的是非安慰剂对照的试验,是将临床上已经使用的治疗药物或治疗方法作为对照进行的临床试验,可看作是两种药物在有效性和安全性上的直接比较。
纵观整个医药市场,第一款上市的药物往往具有很强的先发优势,其疗效和安全性也直接成为后续药物商业化的重要参考标准。当一款后发药物想要获得更多市场份额时,与第一款药物进行“头对头试验”是其最好的选择。
尽管“头对头试验”能够让市场重新认识药物,而一旦失败则将面临极大的风险。对于药品而言,人们只需要效果最好的产品,“头对头试验”失败将严重冲击一款药物的销售前景。
整体而言,伊布替尼一方面拥有很强的先发优势,做了更加广泛的营销渠道建设;另一方面伊布替尼的效果足够优秀,在与后来者的“头对头试验”中并没有落于下风。
频繁的“头对头试验”失败,是后来竞争者的一个缩影,对于创新药而言,先发优势可能远比投资者想象中更大。如果奥布替尼想要超越伊布替尼,其必须像后者那样不断扩增适用症,甚至赢下“头对头试验”。
第二座山:商业化迷途
同一款药物的定价权往往掌控在首款原研药企手中,例如拥有多年先发优势的伊布替尼就牢牢掌握住国内BTK抑制剂的价格话语权。
2017年8月,伊布替尼终于登陆中国市场,并拥有长达三年的市场独占期。由于没有竞争对手,因此强生将伊布替尼的价格定位59.1万元/年(MCL适用症为78.8万元),即使在2018年进入医保后,患者需要负担的治疗费用也在18.5万元/年(MCL适用症为24.7万元)。
在适用症、先发优势缺乏的情况下,迫于竞争压力,迟到三年的泽布替尼只能选择通过价格来抢夺市场。2020年6月上市伊始,泽布替尼就将价格降至25.8万元,并在次年加入医保后,患者负担降低进一步下降至12.4万元。
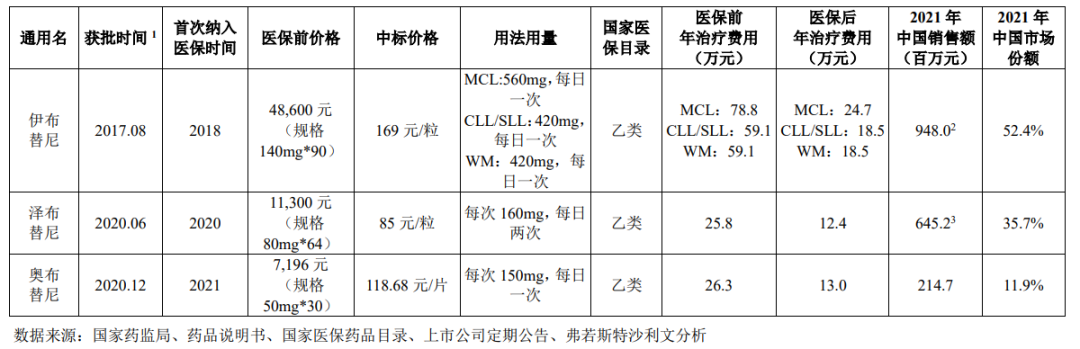
图:中国BTK抑制剂价格与市场份额,来源:招股书
以2021年数据计算,在拥有价格优势后,上市近一年的泽布替尼就收获了35.7%的市场份额,可见治疗费用对患者药物选择有很大的影响。虽然伊布替尼上市很早,但却并未在中国市场建立起足够稳固的护城河,由于医保的原因,价格依然是患者选择BTK抑制剂首要考虑的因素。
聚焦奥布替尼,其在2020年12月获批,错过了当年进入医保的机会,因此在2021年中它都没有价格优势。但就是这样的情况下,奥布替尼依然收获了2.15亿元的营收,占据了11.9%的市场份额。随着今年初奥布替尼正式进入医保,其价格几乎与泽布替尼持平,销售额有望进一步实现放量。
尽管国内BTK抑制剂可以获得一定的市场份额,但这却是通过降低近一半的销售价格实现的,与原研药企相比,国内创新药企面临的竞争压力远超投资者想象。
第三座山:20亿美元门槛
研发一款创新药到底需要多少钱?这个问题很难有一个确定的答案,因为不同靶点,不同技术路线的药物,研发成本有着很大的差异,并不能一概而论。例如fast follow路线的研发费用大概率比first in class低,但同时也需面对更高的商业化难度。
虽然我们无法得到准确的答案,但德勤发布的《2021医药创新回报率评价》报告可以大致给投资者一个参考。德勤分析了全球15家领先的生物制药公司2021年的研发回报率趋势,数据显示这些公司一款创新药的研发成本为20.06亿美元,比2019年的24.31亿美元有明显下降,但同时也远高于2013年的12.96亿美元。
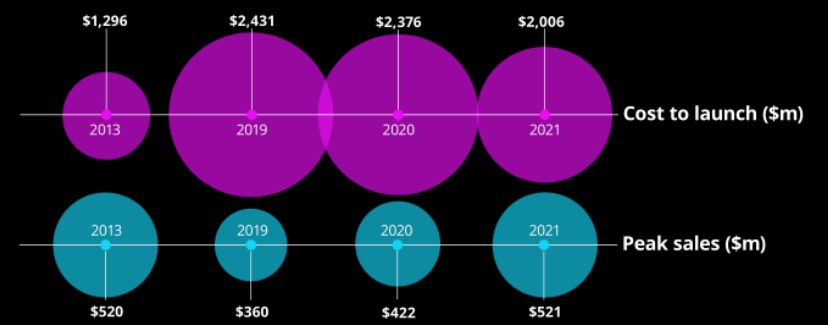
图:一款创新药的研发费用,来源:德勤《2021医药创新回报率评价》
以当下的汇量换算,全球顶尖公司想要真正的让一款创新药从实验室走向市场,那么大致需要消耗140亿元的资金,这样的资金需求量很少有企业能够轻松负担。这也是为何很多巨头企业会选择license-in模式的原因,因为这么做可以大幅降低创新药的研发成本。
对于创新药很多投资者存在一个明显的误区。创新药的研发投入并非仅存在上市之前,即使药品已经成功上市,但很多适应症广的创新药依然需要药企继续投入。
诺诚健华就是一个很好的案例,虽然奥布替尼早已上市,但目前仅在国内获批两个适用症,后续仍有多个适应症正处于临床实验中,也就是说仅在奥布替尼身上,诺诚健华就仍需要投入大量的后续研发支出。
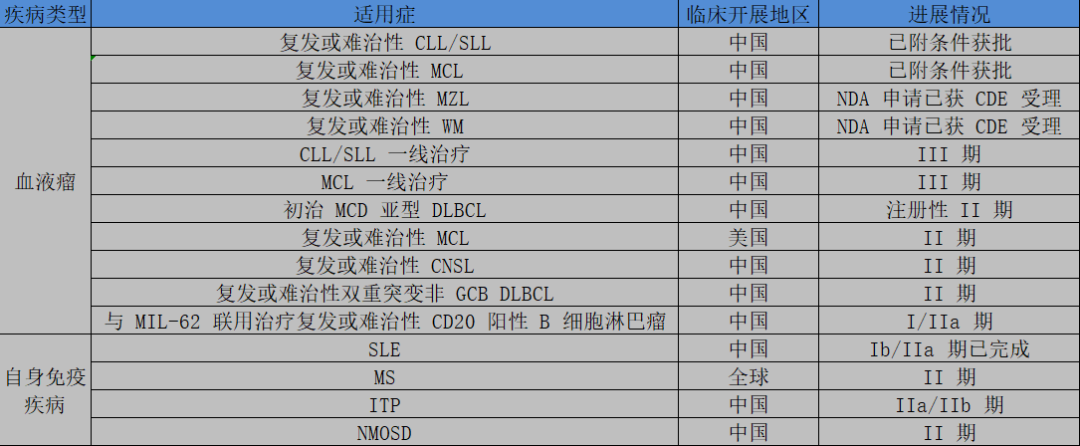
图:奥布替尼适用症进展情况,来源:招股书
2017年-2021年,诺诚健华的研发支出合计15.51亿元,这些资金大部分被用于奥布替尼的研发,但即使如此诺诚健华的研发支出也远低于海外大厂平均140亿元的支出。
难道诺诚健华的效率真的远超海外巨头了吗?答案是否定的。
因为国内和海外药企的研发环境截然不同。国内药物,走得往往是跟随路线,无论是me-too,还是best in class,其本质都是对于国际先进技术的跟随。跟随路线大幅降低了临床早期失败的风险,再加上国内临床试验整体成本较低,这些因素都促成了国内新药成本的显著降低。
可是,这样做有利也有弊。虽然跟随路线降低了创新药的研发成本,但同时也限制了药物的发展,药物雷同度高,缺少充足的海外临床数据支撑,这些因素都阻碍了中国创新药的出海步伐。
或许诺诚健华在奥布替尼身上并不会花费如国际巨头那样多的资金,但其若想成为颠覆BTK抑制剂行业的产品,研发支出必将持续增多。
与其他创新药企相比,诺诚健华账面的60亿资金似乎显得很充足,而如若诺诚健康想要获得更大的市场竞争力,那么依然需要大量的资金消耗。无论是奥布替尼适用症的扩增,还是潜力管线的研发,都需要大量的资金储备。
诺诚健华的未来
诺诚健华是一家很有想法的公司,同时也是一家积极应变的公司。
伊布替尼在BTK领域的强大无需多言,在研发奥布替尼之初,诺诚健华的团队也曾想躲避伊布替尼的锋芒,避开血液瘤靶点而转攻尚未有BTK抑制剂药物上市的自身免疫疾病。由于自身免疫性疾病属于慢病用药,对于安全性有更高的要求,从臻选化合物的环节,诺诚健华就做了严苛的筛选,因此在副作用方面,奥布替尼数据最优。
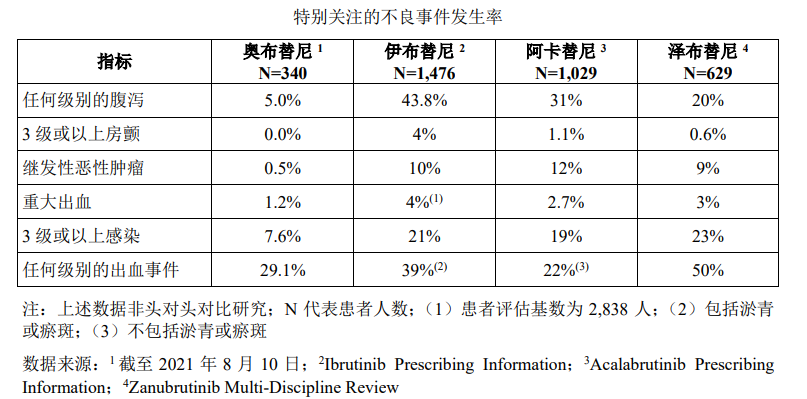
图:各BTK抑制剂副作用概率,来源:招股书
在伊布替尼获批中国市场的2017年,奥布替尼才刚刚进入副作用测试的临床I期阶段,或许是看到了中国血液瘤市场的庞大前景,又或许是奥布替尼在临床I期展现了极低的副作用,最终促使诺诚健华转而开发肿瘤领域适应症。
可以说正是诺诚健华管理层的及时转向,才造就了奥布替尼的上市,如果公司依然专注于自身免疫疾病适用症的研发,那么可能奥布替尼可能依然无法实现商业化。从这个角度,诺诚健华的管理层对行业有着较为清晰的认识,并有很好的战略规划。
疗效方面,奥布替尼同样展现出数据优势。以ICP-CL-00103试验为例,合计入组80名复发或难治性CLL/SLL患者,中位随访时间为33.1个月,最终经研究者评估,客观缓解率(ORR)为93.8%,其中完全缓解率/骨髓恢复不完全的完全缓解(CR/CRi)为26.3%,肿瘤明显缩小的不完全缓解率(PR)为56.3%,伴淋巴细胞增多的PR为11.3%。各项数据均为优于其他BTK抑制剂,有望成为best in class的BTK抑制剂。

图:各BTK抑制剂CLL/SLL适应症疗效,来源:招股书
不过,这些BTK抑制剂们公布的数据仅为各自试验获得的参数,并未开展“头对头试验”,因此这样的数据公信力是不足的。如果奥布替尼想证明自己为同类最优,那么与金标准伊布替尼的“头对头试验”就必不可少。
然而,“头对头试验”相较于传统安慰剂对照试验需要花费更多的资金。由于需要与竞争对手的药物做直接对比,因此需要花费大量的资金购买对手的产品,并维持一个较长的周期。尤其是对抗癌药来说,“头对头试验”成本巨大,一旦遭遇失败那么药企将受到严重影响,这是潜在的风险。
虽然诺诚健华也在努力推进其他管线的研发,如处于临床II期的泛FGFR抑制剂ICP-192和泛TRK小分子抑制剂ICP-723,可能就有下一款获批商业化的产品,但这些都是较为远期的影响。
回归投资层面,诺诚健华未来几年最直接的价值,依然是核心药品奥布替尼的兑现,这款明星药物后续适用症及“头对头试验”的效果都将直接决定诺诚健华的价值。
