十年商业化七款创新药,信达生物(HK:01801)已经基本完成了从Biotech向BioPharma的蜕变。
就在这个“新十年”的起点,信达生物内部人员架构出现重大调整,对营销体系进行了全面重构,负责商业化的首席商务官(CCO)刘敏离职,公司商业化业务架构也被拆分成六个独立的业务单位(BU)。
一直以来,信达生物商业化做的并不差,拳头产品PD-1抑制剂信迪利单抗(简称达伯舒)在2021年的营收约28亿元,是全部国产PD-1抑制剂中销售额仅次于恒瑞卡瑞利珠单抗(2021年销售额41.41亿元)的明星产品。
这不禁给投资者留下一个大大的问号,究竟为何信达生物如此急迫的进行商业化调整?带着这个疑问,我们对信达生物进行了系统复盘,试图通过营销体系剧变这个敞口,进一步细致的观测信达生物这些年的发展。
营销体系全面重构
对于创新药企业而言,商业化是继药物研发后的又一难点,甚至直接关乎公司的生死。一直以来,信达生物的商业化脉络都由CCO刘敏全面负责。
刘敏是在信达生物上市前夕加入公司的,也是商业化团队的首位员工。在来到信达之前,刘敏就已经是“医药圈”响当当的人物,其曾先后任职西安杨森市场经理、阿斯利康CNS BUD、UCB全国销售总监、爱尔康北中国区总经理、罗氏制药肿瘤第二事业部副总裁等职位。
在这位经验丰富的老兵带领下,信达生物商业化团队发展迅速,团队人数很快就接近3000人,渠道覆盖超过5000家医院和1000多家DTP药房。从团队搭建、医保谈判,再到药品出海,都能看到刘敏的身影。
根据最终商业化成绩考量,信达生物交上了一份接近“优秀”的成绩单。以首款商业化产品达伯舒为例,其不仅是首个进入国家医保目录的PD-1抑制剂,而且上市首年就收获10.16亿元的销售额,并在2020年和2021年实现连续增长(2021年没有批准具体数字,仅披露了约70%营收的百分比)。
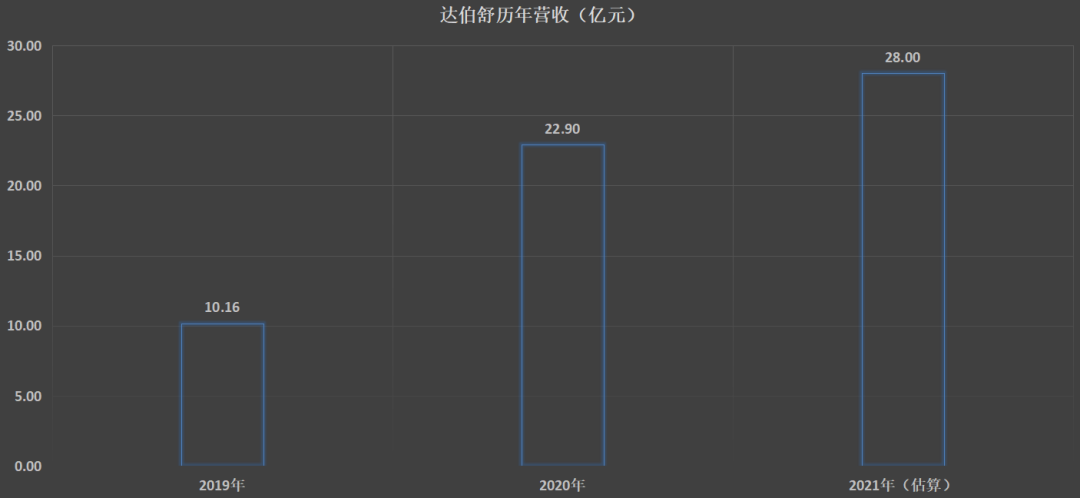
图:达伯舒历年营收(亿元),来源:财报
但即使如此,信达生物的商业化体系仍发生了颠覆性重构。
最大的变化在于,信达生物的商业化体系由过去一个整体被切分成6个BU,分别是IO、VEGF、TKI、血液、GBU、非肿瘤业务,并通过外部引进和内部提拔双等方式寻找BU负责人。信达认为,更加精细化的拆分能够建立更为高效的营销体系,同时也更有利于人才梯队建设,能够让组织保持活力。
整个营销体系被打散后,CCO刘敏以个人原因申请离职,各BU负责人将直接向董事长兼首席执行官俞德超博士汇报。看似信达生物商业化团队更加细化,但实则CEO俞德超的控制权得到进一步增强,他甚至在未来一段时间中将过问各种商业化细节。
对比其他创新药企,信达生物的商业化体系是最稳固的,无论是百济神州还是君实生物,它们的商业化负责人都经历过多次更替,唯独信达生物的刘敏始终稳坐钓鱼台。
此前稳固的职位与如今突然的离职形成了鲜明对比,凸显出了信达生物营销体系改变的出其不意。很多投资者将信达生物营销体系的调整看成是一次主动迭代,但这背后依然存在颇多无奈的味道。
一次充满遗憾的出海
尽管信达生物已经成功商业化7款药物,但其绝大多数的营收依然来自于核心药物达伯舒。以最新的2021财年数据,信达生物PD-1药物的营收占比达到总营收的70%。
按照信达生物过去的发展脉络,PD-1抑制剂达伯舒是一切的核心,一方面国内市场不断扩增,另一方面又有很大的出海机会,这俨然是公司的核心发展推动力。
尤其是对于“出海”,中国创新药企始终有着深深的执念,毕竟开拓海外市场后,能够大幅提升公司的业绩天花板,享受到全球PD-1市场的千亿红利。
但要分食全球医药市场的蛋糕却并不容易,不仅需要面临海外头部药企的竞争,还必须通过FDA的审批,因此想要成功“出海”就需要药企从底层战略层面进行布局,方能挤上“出海”牌桌。
纵观中国创新药企,致力于出海,向FDA发起冲击的很多,但真正获批的到目前为止也仅有百济神州的泽布替尼和传奇生物的CAR-T疗法瑞基奥仑赛注射液两款创新药。虽然中国药企已经有多款PD-1抑制剂上市,但却没有一款能够顺利出海。
得益于出色的疗效,信达生物的核心药物PD-1抑制剂信迪利单抗(简称达伯舒)一度被认为是下一款成功出海的创新药。
为了确保达伯舒出海万无一失,信达生物在2020年8月将达伯舒中国境外独家权利授权给礼来,将由礼来负责达伯舒的海外商业化,信达生物则以里程碑的方式分批获得付款,潜在付款金额高达 10.25 亿美元。
获得达伯舒授权后,礼来很快就在2021年3月向FDA递交上市申请,并于5月18日获得FDA受理。当时,达伯舒提交的是基于ORIENT-1试验,针对非鳞状非小细胞肺癌一线疗法(1L nsqNSCLC)的上市申请。
根据ORIENT-1试验结果,达伯舒联合化疗组的中位无进展生存时间(简称中位PFS)为8.9个月,而对照组仅为5个月,疾病进展的风险下降了52%。依靠ORIENT-1的优异数据,达伯舒已经顺利获得了中国药监局的非鳞状NSCLC适应症批准。
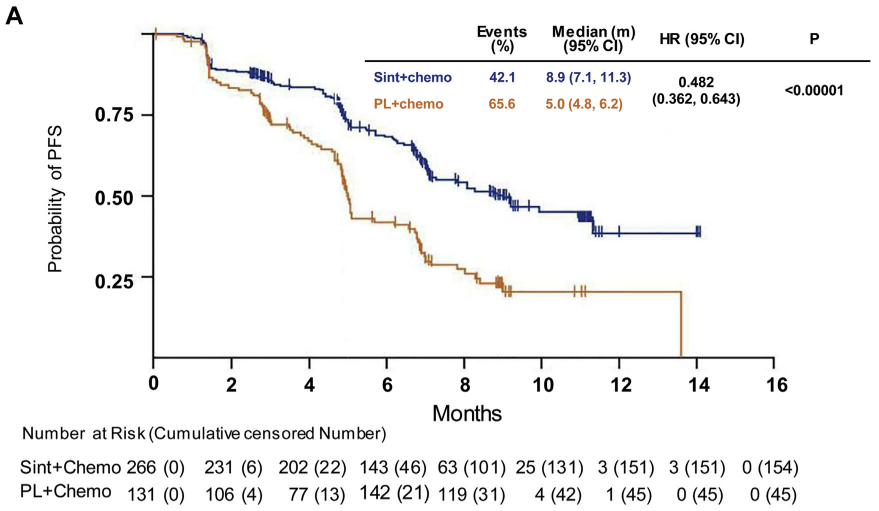
图:ORIENT-11试验结果,来源:Science Direct
如果单论疗效,那么达伯舒获得FDA批准的问题并不大。但谁都没有想到,FDA的肿瘤卓越中心主任 Richard Pazdur 博士在2021年12月15日突然发文,抨击了PD-1赛道Me-too管线扎堆的现象,并认为当时PD-1药物仅依靠非美国的单一国家临床试验获批的现象是有问题的。
Pazdur博士在FDA拥有很高的话语权,他主要负责领导开发和执行综合监管方法的工作,同时还是血液学和肿瘤学产品办公室 (OHOP) 的主任,直接负责整合用于诊断、治疗和预防癌症的药物和治疗性生物制剂的审查。
不幸的是,达伯舒向FDA申请的依据正是基于国内的临床试验,在FDA审核尺度收紧后,最终达伯舒并没有顺利通过组委会投票,而是需要进行补充临床试验才有获批的可能。
原本信达生物希望通过ORIENT-1试验的优秀数据,绕过美国临床直接申请FDA批准。此前,FDA也出现过没有美国临床直接上市的情况,但这必须要有足够强大的数据支撑,并通过专家组的投票表决。
最终,信达生物这种“走捷径”的方式没有获得成功,就算后续补充海外试验,也很难抢到足够的市场份额。对于已经十分内卷的PD-1赛道而言,补充临床试验几乎就意味着将错过宝贵的时间窗口期,达伯舒的经济价值也将大打折扣。
考虑到国内PD-1抑制剂市场不断内卷,遭遇“灵魂砍价”后,达伯舒国内市场的增长潜力也被大幅限制。国内市场受限,海外市场错失,这就导致PD-1这个信达生物的增长引擎即将面临“失速”的问题。
出海逻辑生变后,信达生物显然正在遭遇一次价值重估。
正是基于这样的原因,信达生物才“被迫”进行商业化改革,将产品营销做细,利用更多的新品种来填补由达伯舒所产生的预期“落差”。
现阶段,我们很难说这样的改革利弊几何,毕竟功勋元老刘畅离职,信达生物或将面临商业化团队改变所带来的冲击。
信达启示录
拥有足够临床数据支撑的情况下,达伯舒却依然被要求延缓上市,这背后十分值得中国药企们反思。
在信达生物过去的商业化体系中,PD-1抑制剂占据了无比重要的分量,伴随着国内市场因价格原因大幅萎缩,俨然海外市场就成为信达生物业绩增长的“救命稻草”。
尽管达伯舒拥有疗效优势,但却因为缺少多市场的临床数据而被拒绝,这表面看是信达生物的布局失误,实则却是中国创新药企策略的集体挫败。
信达生物的管理层当然知道,缺少美国临床试验会遇到问题,但对于当时的信达来说它只有孤注一掷一条路。达伯舒申请美国上市时,美国市场实则已经拥有了7款PD-1产品,同时还有35款PD-1抑制剂正在美国开展临床,就算达伯舒按照常规在美国开展临床试验,那么它也很难跑出来。本质上,美国的PD-1抑制剂本就是一个接近于饱和的市场,无论怎么做,达伯舒其实都存在上市失败风险的。当时礼来看重达伯舒主要是希望通过价格优势来撬动市场,显然从最终的结果看这样的想法有些太过于天真。
凭心而论,达伯舒带给美国市场的仅是价格冲击,即使没有这款产品,美国医药市场的PD-1产品依然能够自足。纵观已经成功出海的两款国内产品,其实都享受到了时间窗口红利,在同靶点产品上市数量很少的情况下获批的,如果这一靶点中已经有多个产品获批,那么就算疗效很好也依然存在不小的失败风险。
对中国药企而言,FDA的这种创新药的审批态度影响尤甚。由于起步较晚,因此很多中国创新药企业并没有选择“first in class”的研发策略,而是退而求其次的选择“best in class”作为研发指导。这就导致先进管线并非中国创新药企擅长的地方,而更多扎堆于成熟管线的研发上,很容易出现内卷的现象。
因此,在出海这件事上,中国创新药企理应更加理性。出海绝不是创新药企的救命稻草,而更应该是一件锦上添花的事情。
其实即使失去了出海的机会,信达生物也依然具备很强的研发竞争力,罗氏、礼来、赛诺菲等多家药企巨头都选择与信达生物展开合作,赛诺菲更是又出钱又出力。8月4日,信达生物宣布与赛诺菲达成合作,信达不仅获得了两项具备“first in class”潜力管线的合作,而且还获得了来自于赛诺菲的3亿欧元股权投资,当时的认购价格溢价超20%。
创新药企发展并非只有“出海”一条路,与其在没有准备好的情况下被FDA否决,倒不如踏实下来先打好根基。对于信达生物来说,出海逻辑虽然遭到了破坏,但这却只能破坏公司的短期逻辑,从长期发展角度看,信达生物的研发能力依然能够支撑公司的发展。
